KOH和KHCO3固体的混合物25.6 g 于250 ℃进行煅烧 冷却后混合物质量损失了4.9 g。
| KOH和KHCO3固体的混合物25.6 g,于250 ℃进行煅烧,冷却后混合物质量损失了4.9 g。 (1)求起始混合物的百分组成。 (2)若混合物的质量损失改为2.1 g,这时起始混合物的百分组成又是多少? |
参考解答
| 21.875%和78.125%;45.6%和54.4%。 |
| 用“差量法”判断谁过量。 假设25.6 g混合物是由KOH和KHCO3恰好完全反应的质量比混合而成的,则 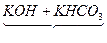 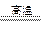 K2CO3+H2O 差量 K2CO3+H2O 差量156 18 25.6 g x 经计算,求得理论差量x='2.95' g。 题目中,第一种情况实际差量>2.95 g,为KHCO3过量。由“钾守恒”,残留的固体25.6 g-4.9 g='20.7' g为K2CO3,则通过列二元方程组,可求得KOH和KHCO3固体各自的质量。题目中,第二种情况实际差量<2.95 g,为KOH过量,由方程式运算可直接求得KHCO3的质量。 |
相似问题
下列关于金属钠的物理性质的描述 错误的是A.熔点小于100CB.银白色金属C.质软 可以用刀切割D.
下列关于金属钠的物理性质的描述,错误的是A.熔点小于100CB.银白色金属C.质软,可以用刀切割D.比煤油的密度还小
把标准状况下4.48 L的CO2通过一定量的固体Na2O2后 收集到标准状况下3.36 L气体。则这
把标准状况下4 48 L的CO2通过一定量的固体Na2O2后,收集到标准状况下3 36 L气体。则这3 36 L气体的质量是……………………………………………………(
钾比钠更活泼的主要原因是( )A.钾的核电荷数比钠大B.钾的相对原子质量比钠大C.钾 钠最外层都
钾比钠更活泼的主要原因是()A.钾的核电荷数比钠大B.钾的相对原子质量比钠大C.钾、钠最外层都只有一个电子但钾比钠多一个电子层D.钾、钠都是银白色
将2.3g CO和H2的混合物气体与足量O2充分燃烧后 立即通入足量的Na2O2固体中 固体的质量增
将2 3g CO和H2的混合物气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加A.2 3 gB.3 6 gC.7 2 gD.4 6 g
20℃时碳酸钠 碳酸氢钠的溶解度分别为:21.2g 9.6g。现有20℃时的碳酸钠饱和溶液60.6g
20℃时碳酸钠、碳酸氢钠的溶解度分别为:21 2g、9 6g。现有20℃时的碳酸钠饱和溶液60 6g,向其中通入二氧化碳气体,刚好完全反应。设反应前、后溶液温度












