(1)Na2CO3固体中混有少量NaHCO3固体 除去的方法是_____________ 化学方程式
| (1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是_____________,化学方程式为______________________________________________。 (2)NaHCO3溶液中混有少量Na2CO3,除去的方法是____________________,反应的离子方程式为_________________________________________。 (3)NaOH溶液中混有少量Na2CO3,除去的方法是_______________________,反应的离子方程式为_________________________________________。 (4)CO2中混有少量的SO2,除去的方法是________________________,反应的化学方程式为_____________________________________。 |
参考解答
(1)加热 2NaHCO3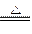 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑(2)在溶液中通入过量CO2 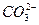 +CO2+H2O====2 +CO2+H2O====2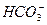 (3)滴入适量的Ca(OH)2溶液 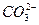 +Ca2+====CaCO3↓ +Ca2+====CaCO3↓(4)将混合气体通入饱和NaHCO3溶液 SO2+2NaHCO3====Na2SO3+2CO2+H2O |
| 依据除杂原则选择除杂试剂。除杂质的试剂只能与杂质反应,且不引入新的杂质(如果有新杂质引入,新杂质必须较容易除去,如利用加热分解、挥发等)。 |
相似问题
在一密闭容器中加入xmol的Na2O2和ymol的NaHCO3固体充分加热 下列有关加热后容器中残留
在一密闭容器中加入xmol的Na2O2和ymol的NaHCO3固体充分加热,下列有关加热后容器中残留固体成分和导出气体成分的说法正确的是A.若x=y,气体中只含有0 5x
制取相同质量的CO2 若要节省酸 可选下列哪种物质( )A.NaHCO3B.Na2CO3C.CaCO
制取相同质量的CO2,若要节省酸,可选下列哪种物质()A.NaHCO3B.Na2CO3C.CaCO3D.K2CO3
下列叙述正确的是…( ) A.碱金属元素与氧气化合生成的氧的化合物均属于碱性氧化物; B.由于碱金属
下列叙述正确的是…( ) A.碱金属元素与氧气化合生成的氧的化合物均属于碱性氧化物; B.由于碱金属形成的碱均为强碱,所以碱金属形成的盐均不水解
用脱脂棉包住约0.2g过氧化钠粉末 置于石棉网上 向脱脂棉上滴水 观察到脱脂棉剧烈燃烧起来.(1)由
用脱脂棉包住约0 2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.(1)由上述实验现象所得到的过氧化钠跟水反应的结论是:①
金属K与Na金属性相近 用金属K与钠盐共熔时 很难将Na从混合物中分离。若调整温度到一定程度 则可用
金属K与Na金属性相近,用金属K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔沸点如下:K












