某反应物和产物均为气态的可逆反应在一定条件下达到平衡状态 在T时刻改变条件 平衡被破坏 在新的条件下
某反应物和产物均为气态的可逆反应在一定条件下达到平衡状态,在T时刻改变条件,平衡被破坏,在新的条件下又可建立新的平衡。化学反应速率的变化规律的图像如图所示。观察图像,据此判断T时改变的条件可能是下列的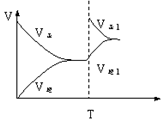
|
参考解答
| D |
专题:化学平衡专题. 分析:由图象可知,正逆反应速率相等时化学反应达到化学平衡状态,图象中改变条件使正逆反应速率都增大,且正反应速率增大的倍数大于逆反应速率增大的倍数,化学平衡正向移动,并注意改变条件的瞬间逆反应速率不变来解答. 解答:解:A、升高温度时,正逆反应速率都增大,应与原平衡状态无接触点,所以与图象不相符,故A错误; B、增大压强,正逆反应速率都增大,应与原平衡状态无接触点,所以与图象不相符,故B错误;C、使用催化剂能同等程度的改变正逆反应速率,但正逆反应速率还相等,应与原平衡状态无接触点,所以与图象不相符,故C错误; D、增大反应物的物质的量,化学平衡正向移动,正逆反应速率都增大,且正反应速率增大的倍数大于逆反应速率增大的倍数,且改变条件的瞬间逆反应速率不变,与图象相符,故D正确;故选D。 点评:本题考查影响化学反应速率及化学平衡的条件及图象分析,明确图象中正逆反应速率的变化及改变条件的瞬间逆反应速率不变是解答的关键。 |
相似问题
把4 mol N2和8 mol H2置于5 L密闭容器合成氨反应 经过2min后达到平衡时测得混合气
把4 mol N2和8 mol H2置于5 L密闭容器合成氨反应,经过2min后达到平衡时测得混合气体中含NH3的体积百分比为20%,求:(1)混合气体中含H2的体积百分比
下图为装有活塞的密闭容器 内盛22.4 mL一氧化氮。若通入11.2 mL氧气(气体体积均在标准状况
下图为装有活塞的密闭容器,内盛22 4 mL一氧化氮。若通入11 2 mL氧气(气体体积均在标准状况下测定)保持温度、压强不变,则容器内气体的密度( ) A.等
在1 L密闭容器中 充入一定量的A发生反应:A(g)2B(g)(正反应为放热反应)。当反应达到平衡后
在1 L密闭容器中,充入一定量的A发生反应:A(g)2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两
下列能表明可逆反应: A +2B2C 已达平衡状态的的是A. A B C的浓度相等B. 当生成
下列能表明可逆反应: A +2B2C 已达平衡状态的的是A A、B、C的浓度相等B 当生成1molA的同时也生2molBC A、B、C的物质的量比为1:2:2D 当生成1molA的同时也生成2molC
下列关于化学反应说法中正确的是A.化学键的断裂和形成是化学反应中能量变化的主要原因B.化学反应速率为
下列关于化学反应说法中正确的是A.化学键的断裂和形成是化学反应中能量变化的主要原因B.化学反应速率为0 8 mol (L·s)是指1s 内生成0 8mol该物质












