氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质 为制得纯净的氯化铜晶体 首先将其制成水溶液
氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。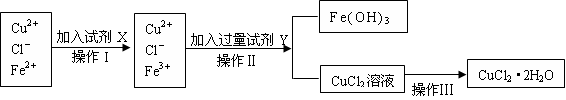 请参照下表给出的数据填空。
⑵下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。 A、KMnO4 B、H2O2 C、NaClO D、Cl2 ⑶操作II的Y试剂为_______________(填化学式),并调节溶液的pH在______范围。 ⑷实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示)__________________________________________________________。 ⑸若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法______________________________________________。 |
参考解答
| (共14分)⑴加入氧化剂,使Fe2+氧化为Fe3+(2分) ⑵B、D(2分) ⑶CuO(2分);3.2≤pH<4.7(2分) ⑷Cu2+水解:Cu2++2H2O  Cu(OH)2+2H+ ,(2分)加入盐酸抑制其水解(1分)。 Cu(OH)2+2H+ ,(2分)加入盐酸抑制其水解(1分)。⑸CuO(2分),HCl气流中蒸发(1分)。 |
试题分析:由于Fe2+沉淀为Fe(OH)2的pH值与Cu2+沉淀为Cu(OH)2的pH较大,而与Fe3+沉淀为Fe(OH)3的pH相差较大,所以可以通过先将Fe2+氧化为Fe3+,再调节溶液的pH使铁以Fe(OH)3沉淀形式而被除去。为了使加入的氧化剂不带入新的杂质,显然用H2O2最好。出于同样的考虑,加入y调节溶液pH值时,应选用能与H+反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使pH值升高太多而使Cu2+沉淀。 (1)根据操作I后离子的变化可知,操作目的是加入氧化剂,将亚铁离子氧化生成铁离子的。 (2)由于在实验中不能再引入新的杂质,所以选项AC不正确;双氧水的还原产物是水、氯气的还原产物是氯离子,不会引入杂质,答案选BD。 (3)Y试剂的目的是沉淀铁离子,所以加入的试剂应该是氧化铜。铁离子完全沉淀时的pH是3.2,铜离子开始沉淀时的pH是4.7,所以调节溶液的pH应该在3.2≤pH<4.7。 (4)氯化铜溶于水Cu2+水解:Cu2++2H2O  Cu(OH)2+2H+ ,所以加入盐酸的目的是抑制其水解。 Cu(OH)2+2H+ ,所以加入盐酸的目的是抑制其水解。(5)铜离子水解吸热,且生成的氯化氢极易挥发,所以若将CuCl2溶液蒸干得到的固体是氢氧化铜,灼烧得到的是氧化铜。所以要得到氯化铜晶体应该在HCl气流中蒸发。 点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生规范、严谨的实验设计能力,提升学生的学科素养。该类试题需要注意的是该题需要明确的这种类型的试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。 |
相似问题
现有一瓶A和B的混合液 已知A和B的某些性质如下:物质分子式熔点℃沸点℃密度g?cm-3水溶性AC3
现有一瓶A和B的混合液,已知A和B的某些性质如下:物质分子式熔点℃沸点℃密度g?cm-3水溶性AC3H6O2-9857 50 93可溶BC4H8O2-84770 90可溶由此,分
如图装置进行实验 将液体A逐滴加入到固体B中 下列叙述正确的是 A.若A为浓硝酸 B为金属铜 C中
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是A.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝B.若A为浓盐酸,B为MnO2
下列实验方案合理的是( )A.鉴别苯和甲苯:分别加入溴水振荡B.检验酒精中的少量水:向酒精中
下列实验方案合理的是( )A.鉴别苯和甲苯:分别加入溴水振荡B.检验酒精中的少量水:向酒精中加入无水硫酸铜C.制备纯净的氯乙烷(C2H5Cl):将乙烷和氯
为了除去硫酸铜溶液中含有的Fe2+杂质 先加入合适的氧化剂使Fe2+氧化为Fe3+ 下列物质中最好选
为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用A.H2O2溶液B.KMnO4溶液C.Cl2水D.HNO3溶液
小明同学用洁净的铂丝蘸取某无色溶液 在无色火焰上灼烧 火焰呈黄色 通过该实验现象 下列四位同学对该溶
小明同学用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子的判断正确的是 ( )












