(16分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图
(16分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: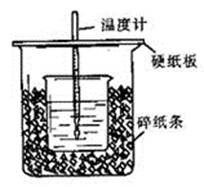 (1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________。 (2)25℃,101kPa时,1mol稀硫酸与氢氧化钠稀溶液完全反应生成液态水放出114.6kJ的热量,表示该反应中和热的热化学方程式为________________________________________。 (3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”、“偏小”、“无影响”)。 (4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”、“不相等”),所求中和热_________(填“相等”、“不相等”),简述理由___________________ _________________。 (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________________________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会____________ ______。(均填“偏大”、“偏小”、“无影响”) |
参考解答
| (共16分)(1)环形玻璃搅拌棒(2分); (2)NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H= -57.3kJ/mol (2分); (3)偏小 (2分); (4)不等(2分); 相等(2分); 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关(2分)。 (5)偏小(2分);偏小(2分) |
| (1)在反应热的测定实验中需要进行搅拌,保证反应的两种溶液可以迅速反应,缩短反应的时间,减小误差,所以装置中缺少的玻璃用品是环形玻璃搅拌棒。 (2)1mol稀硫酸与氢氧化钠稀溶液完全反应生成液态水为2mol,放出的热量为114.6kJ,则生成1mol水时放出的热量为114.6/2=57.3kJ,又中和反应放热所以焓变为负值,△H= -57.3kJ/mol根据热化学方程式的书写原则写出所求的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H= -57.3kJ/mol (3)若烧杯上不盖硬纸板会导致热量散失,左侧的中和热的数值也会偏小。 (4)改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应氢氧化钠反应完全生成的水为0.0275mol,原反应盐酸反应完全生成的水为0.025mol,反应生成水的量不同,所以放出的热量也不相等;但是所求的中和热相等,因为中和热指酸碱发生中和反应生成1mol水时所放出的热量,与酸和碱的用量没有关系。 (5)氨水属于弱碱,在溶液中部分电离,反应过程中会发生电离,电离吸热,会吸收反应所放出的热量,所以测得的中和热数值会偏小;用50 mL 0.50 mol/L NaOH溶液进行上述实验会导致反应不充分,测得的反应热会偏小。 |
相似问题
下列物质中 既有离子键又有共价键的是A.CaCl2B.KOHC.H2OD.H2SO4
下列物质中,既有离子键又有共价键的是A.CaCl2B.KOHC.H2OD.H2SO4
下列物质中既有离子键又有共价键的是A.H2SO4B.Ca(OH)2C.H2O2 D.CH3COOH
下列物质中既有离子键又有共价键的是A.H2SO4B.Ca(OH)2C.H2O2 D.CH3COOH
下列氧化反应属于吸热反应的是( )A.工业上制氨气的反应B.葡萄糖在人体内氧化分解C.锌粒与稀H2
下列氧化反应属于吸热反应的是()A.工业上制氨气的反应B.葡萄糖在人体内氧化分解C.锌粒与稀H2SO4反应制取H2D.Ba(OH)2·8H2O与NH4Cl反应
下列反应中属于吸热反应的是( )A.CaO+H2O===Ca(OH)2B.C+H2OCO+H2C.
下列反应中属于吸热反应的是( )A.CaO+H2O===Ca(OH)2B.C+H2OCO+H2C.HCl+NaOH===NaCl+H2OD.2Al+3H2SO4===Al2(SO4)3+3H2↑
下列分子中键角最小的是 ( )A.CH4B.NH3C.BF3D.CO2
下列分子中键角最小的是( )A.CH4B.NH3C.BF3D.CO2












