利用N2和H2可以实现NH3的工业合成 而氨又可以进一步制备硝酸 在工业上一般可进行连续生产。请回答
| 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题: (1)已知:N2(g) + O2(g) === 2NO(g) △H= +180.5kJ/mol N2(g) + 3H2(g)  2NH3(g) △H=-92.4kJ/mol 2NH3(g) △H=-92.4kJ/mol2H2(g) + O2(g) ="==" 2H2O(g) △H=-483.6kJ/mol 若有17 g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______。 (2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)  2NH3(g)反应的影响。 2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量) 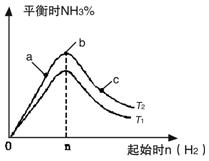 ①图像中T2和T1的关系是:T2 ______T1(填“高于”、“低于”、 “等于”或“无法确定”)。 ②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最 高的是______(填字母)。 ③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________________________。 (3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。 ①一定温度下,在恒容密闭容器中N2O5可发生下列反应: 2N2O5(g) 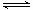 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据 则500s内NO2的平均生成速率为 。 ②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5, 装置如图所示,其中Y为CO2。 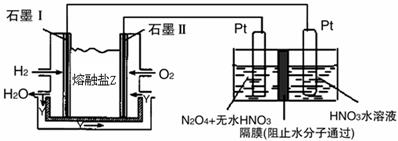 写出石墨I电极上发生反应的电极反应式 。 在电解池中生成N2O5的电极反应式为 。 |
参考解答
(1)226.3 kJ (2)① 低于 ② c ③ n/3 ; 2.08L2/mol2 (3)① 0.00592 mol?L-1?s-1 ② H2 + CO32--2e- =' ' CO2 + H2O 阳极:N2O4 + 2HNO3 - 2e— =' ' 2N2O5 + 2H+ |
| 略 |
相似问题
知道了某过程有自发性之后 则 A.可判断出过程的
知道了某过程有自发性之后,则A.可判断出过程的方向B.可确定过程是否一定会发生C.可预测过程发生完成的快慢D.可判断过程的热效应
下列说法或表示方法正确的A.已知C(s)+O2(g)===CO2(g);C(s)+O2(g)= =C
下列说法或表示方法正确的A.已知C(s)+O2(g)===CO2(g);C(s)+O2(g)= =CO (g),则B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l);kJ·mol-1,若将含0 5mo
(14分)有一包白色固体粉末 其中可能含有NaCl Ba(NO) CuSO NaCO中的一种或几种
(14分)有一包白色固体粉末,其中可能含有NaCl、Ba(NO)、CuSO、NaCO中的一种或几种,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成,过
已知══ 反应速率分别用 表示 下列关系正确的是( )A.B.C.D.
已知══,反应速率分别用、、表示,下列关系正确的是( )A.B.C.D.
下列含有极性键的离子化合物是A.CH3COOHB.NaOHC.Na2O2D.MgCl2
下列含有极性键的离子化合物是A.CH3COOHB.NaOHC.Na2O2D.MgCl2












