化学能的转化在现实生活中得到了广泛的利用。回答以下问题:(Ⅰ)(1)在25℃ 101kPa下 1g甲
| 化学能的转化在现实生活中得到了广泛的利用。回答以下问题: (Ⅰ)(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式: 。 (2)2Zn(s)+O2(g)=2ZnO(s) ΔH1=" —702" kJ/mol 2Hg(l)+O2(g)=2HgO(s) ΔH2=" —182" kJ/mol 由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。 (3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 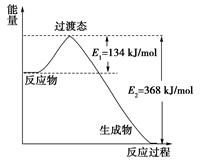 (Ⅱ)下图为相互串联的甲乙两个电解池: 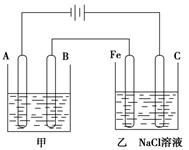 请回答: (1)甲池若为用电解原理精炼铜的装置,则: A极是 极,材料是 ,电极反应为 , B极是 极,材料是 ,电极反应为 , 电解质溶液为 。 (2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。 (3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积 _________________。 (4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为 __ _____。 |
参考解答
| (Ⅰ)(1)CH4(g)+2O2(g)==== CO2(g)+ 2H2O(g) ΔH =' —880' kJ/mol (2)+260 kJ/mol (3)NO2(g)+CO(g)='===' CO2(g)+NO(g) ΔH =' —234' kJ/mol (Ⅱ)(1)阴 纯铜 Cu2++2e-=Cu 阳 粗铜 Cu-2e-=Cu2+ CuSO4溶液 (2)红 (3)4.48 L (4)1mol/L |
| (Ⅰ)(1)由题目信息可折算出1mol甲烷完全燃烧生成稳定的氧化物时所放出的热量为16×55=880kJ,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)==== CO2(g)+ 2H2O(g) ΔH =' —880' kJ/mol (2)根据所给两热化学方程式可得到: ①ZnO(s)=Zn(s)+1/2O2(g) ΔH1=' +351' kJ/mol ②Hg(l)+1/2O2(g)=HgO(s) ΔH2= —91kJ/mol ①+②得到:ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=+260 kJ/mol (3)由图可知,该反应为放热反应,△H3=134—368=—234 kJ/mol,故热化学方程式为: NO2(g)+CO(g)='===' CO2(g)+NO(g) ΔH =' —234' kJ/mol II(1)甲池若为精炼铜的装置,电解质溶液应为铜盐,经常用硫酸铜溶液,则: 粗铜做阳极,即与外电源的正极相连的B极:Cu-2e-=Cu2+ 纯铜做阴极,即A极:Cu2++2e-=Cu (2)乙池中铁极做为电解池的阴极:2H2O+2e-=H2↑+2OH-,溶液呈碱性,滴入酚酞后呈红色 (3)甲槽阴极析出铜增重,则乙槽阳极放出氯气:2Cl-2e-=Cl2↑,由关系式Cu~2e-~Cl2↑,可知氯气在标准状况下的体积为  =4.48L =4.48L(4)由关系式2OH-~Cl2↑可知,c(OH-)= 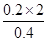 =1mol/L =1mol/L |
相似问题
下列物质中含有非极性键的分子是A.Na2O2B.CH4C.N2D.CO2
下列物质中含有非极性键的分子是A.Na2O2B.CH4C.N2D.CO2
下列说法正确的A.放热反应在常温下一定容易进行B.植物的光合作用是把太阳能转化为热能的过程C.反应是
下列说法正确的A.放热反应在常温下一定容易进行B.植物的光合作用是把太阳能转化为热能的过程C.反应是放热还是吸热是由反应物和生成物所具有的能量的相
构成下列物质的粒子中所含化学键的类型和该固态物质晶体类型均相同的是A.HCl和NaClB.CO2和S
构成下列物质的粒子中所含化学键的类型和该固态物质晶体类型均相同的是A.HCl和NaClB.CO2和SiO2C.CH4和CCl4D.Na2O2和H2O2
(6分)在下列物质中:①NaCl ②NaOH ③Na2O2 ④CH2O ⑤(NH4)2S ⑥CC
(6分)在下列物质中:①NaCl ②NaOH ③Na2O2④CH2O⑤(NH4)2S⑥CCl4⑦C2H2⑧SiC⑨晶体硅⑩金刚石(选填序号)(1)其中只含有离子键的离子晶体是;(2
下列物质中σ键和π键数目比为1 :2的是A.乙烯B.乙炔C.二氧化碳D.氮气
下列物质中σ键和π键数目比为1 :2的是A.乙烯B.乙炔C.二氧化碳D.氮气












