(7分)分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和
| (7分)分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。 (1)理论上稀强酸、稀强碱反应生成1 mol 水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________________。 (2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是_____________________________________________; 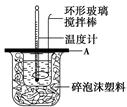 (3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
F.反应后混合溶液的质量 (4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=________; | |||||||||||||||||||||||
参考解答
| (1)NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol(2分) (2)减少热量损失(1分) (3)ACE(2分) (4)-51.8 kJ/mol (2分) |
| (1)在稀水溶液中,酸碱中和生成盐和1mol水时放出的热量; (2)因该反应要测反应中放出的热量,为提高实验结果的准确性,故当然要减少热量损失; (3)利用关系式:Q=-C(T2-T1),可以看出:选ACE; (4)以第一组实验为例:t1=(20.0+20.1)/2=20.05℃,则公式中(T2-T1)=23.2-20.05=3.15℃; 同理,第二组实验中,(T2-T1)=3.1℃;第三组实验中,(T2-T1)=3.05℃; 则三组实验的(T2-T1)平均值为3.1℃,带入关系式,得: Q='-4.18' J/(g·℃)×80 g×3.1℃=1.03664KJ 则生成1mol水时放出的热量='1.03664KJ÷0.02mol×1mol=51.8' KJ,即ΔH=-51.8 kJ/mol |
相似问题
常温常压下 下列说法正确的是A.含有离子键的物质一定是离子化合物B.同素异形体之间的转化是物理变化C
常温常压下,下列说法正确的是A.含有离子键的物质一定是离子化合物B.同素异形体之间的转化是物理变化C.含有共价键的物质一定是共价化合物D.气态物质
(12分)下列五种物质中① Ar ② H2O2 ③ NH4 NO3 ④ KOH ⑤ Na2O2 ⑥
(12分)下列五种物质中① Ar② H2O2③ NH4 NO3④ KOH⑤ Na2O2⑥ CaCl2只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存
下列各式能真实表示物质分子组成的是( )A.CaF2B.CCl4C.SiO2D.Na2O2
下列各式能真实表示物质分子组成的是()A.CaF2B.CCl4C.SiO2D.Na2O2
冰的晶体中存在的最强作用力是 A.离子键B.共价键C.氢键D.分子间作用力
冰的晶体中存在的最强作用力是 A.离子键B.共价键C.氢键D.分子间作用力
下列物质中 只含有共价键的化合物是A.NaB.N2C.CO2D.KCl
下列物质中,只含有共价键的化合物是A.NaB.N2C.CO2D.KCl












