用如图装置进行电解实验(a b c d均为铂电极) 供选择的有4组电解液 要满足下列要求:组A槽B槽
用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
②b、c两极上反应的离子的物质的量相等. (1)应选择的电解质是上述四组中的第______组. (2)该组电解过程中各电极上的电极反应式为: a极______;b极______;c极______;d极______. (3)当b极上析出7.1g电解产物时,a极上析出产物的质量为______g;若B槽电解质溶液500mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了______mol/L. 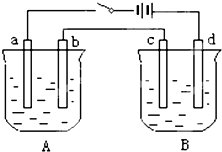 |
参考解答
| 1组、A槽是电解水,氢氧化钠溶液PH增大,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硫酸铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e-=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等: 2组、A槽是电解硝酸银,溶液PH减小,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解氯化铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e-=Cu,依据电子守恒可知,b、c两极上反应的离子的物质的量不相等: 3组、A槽是电解水,硫酸钠溶液PH不变,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e-=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等: 4组、A槽是电解氯化钠,氯化钠溶液PH增大,b电极是阳极,电极反应为:4OH--4e-=2H2O+O2↑;B槽电解硝酸银溶液,溶液PH减小,c电极为阴极,电解反应为:4Ag++4e-=4Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相等: (1)依据上述分析可知,符合条件的是滴4组;故答案为:4; (2)该组电解过程中各电极上的电极反应式为:a、4H++4e-=2H2↑;b、4Cl--4e-=2Cl2↑;c、4Ag++4e-=4Ag;d、4OH--4e-=2H2O+O2↑; 故答案为:4H++4e-=2H2↑;4Cl--4e-=2Cl2↑;4Ag++4e-=4Ag;4OH--4e-=2H2O+O2↑; (3)a、4H++4e-=2H2↑;b、4Cl--4e-=2Cl2↑;当b极上析出7.1g电解产物为氯气物质的量为0.1mol,a极上析出产物为氢气,氢气的物质的量为0.1mol,氢气的质量为0.1mol×2g/mol=0.2g;若B槽电解质溶液500mL,且忽略电解前后电解液的体积变化,电解过程中氢氧根离子减少和氢离子增加相同,依据电子守恒和电极反应可以计算得到,4OH--4e-=2H2O+O2↑电子转移0.2mol消耗氢氧根离子0.2mol,溶液中增加氢离子为0.2mol,则此时B槽中的c(H+)比电解前增加了
故答案为:2g;0.4; |
相似问题
500mLKNO3和Cu(NO3)2的混合溶液中 c(NO3)=6.0mol/L.用石墨作电极电解此
500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6 0mol L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22 4L气体(标准状况),假设电解后溶
取一张用饱和NaCl溶液浸湿的pH试纸 两根铅笔芯作电极 接通直流电源 一段时间后 发现b电极与试纸
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色
以惰性电极电解一定量的CuSO4溶液 若阳极上产生气体的物质的量为0.01mol 则阴极上析出Cu的
以惰性电极电解一定量的CuSO4溶液,若阳极上产生气体的物质的量为0 01mol,则阴极上析出Cu的质量可能为( )A.1 00gB.1 92gC.2 56gD.5 12g
将质量相等的Ag片和铂片插入硝酸银溶液(足量)中 银片与电源正极相连 铂片与电源负极相连。以电流1
将质量相等的Ag片和铂片插入硝酸银溶液(足量)中,银片与电源正极相连,铂片与电源负极相连。以电流1A通电10min,然后反接电源,以电流2A继续通电10min。
有关甲 乙 丙 丁四个图示的叙述正确的是[ ] A.甲中负极反应式为:2H++2e-=H2↑
有关甲、乙、丙、丁四个图示的叙述正确的是[ ] A.甲中负极反应式为:2H++2e-=H2↑ B.乙中阳极反应式为:Ag++e-==Ag C.丙中H+向碳棒方向移动D












