“化学与技术”模块海洋是一座巨大的宝藏 若把海水淡化和化工生产结合起来 既可解决淡水资源缺乏的问题
| “化学与技术”模块 海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”. (1)常用的海水淡化方法有______法、______法(电渗析、反渗透)、冷冻法、离子交换法等. (2)如图是电渗析法淡化海水的原理图.其中,电极A接直流电源的正极,电极B接直流电源的负极. ①隔膜A是______(填:阴离子交换膜或阳离子交换膜) ②从宁波港采集的海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-. 若用上述装置对采自宁波港的海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、 pHc,则其大小顺序为______. ③请写出用电渗析法对采自宁波港的海水进行淡化处理时所发生的化学反应方程式______. (3)具有暂时硬度的硬水在长时间加热煮沸后,生成沉淀的主要成分是______. (4)为获得纯净水(去离子水),某同学在实验室将含Mg2+、Ca2+、Cl-的硬水先后通过阴离子交换树脂[如RN(CH3)3OH]和阳离子交换树脂[如RSO3H],写出Cl-与上述离子交换反应的方程式______;结果实验未获得成功,其可能原因是______. 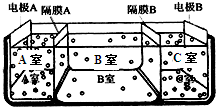 |
参考解答
| (1)海水淡化常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等,故答案为:蒸馏;膜; (2)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,故答案为:阴离子交换膜; ②电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,故答案为:pHa<pHb<pHc; ③电解氯化钠的反应原理为:2NaCl+2H2O
(3)水垢的主要成分是氢氧化镁和碳酸钙,也是具有暂时硬度的硬水在长时间加热煮沸后生成沉淀的主要成分,故答案为:CaCO3、Mg(OH)2; (4)阴离子交换树脂可以实现阴离子之间的交换,所以Cl-与阴离子交换树脂反应的方程式为:RN(CH3)3OH+Cl-═RN(CH3)3Cl+OH-,碱性环境下,镁离子易形成沉淀物,会堵塞了离子交换柱,所以离子交换树脂有时不起作用,故答案为:阴离子交换树脂交换出的OH-和Mg2+、Ca2+等反应生成沉淀堵塞了离子交换柱. |
相似问题
电解CuCl2溶液时 如果阴极上有1.6gCu析出 则阳极上产气体的体积(标况)约为( )A.0.
电解CuCl2溶液时,如果阴极上有1 6gCu析出,则阳极上产气体的体积(标况)约为( )A.0 28LB.0 56LC.0 14LD.11 2L
如图所示 a b c d均为石墨电极 通电进行电解 下列说法正确的是 [ ]A.乙池中d的
如图所示,a,b,c,d均为石墨电极,通电进行电解,下列说法正确的是 [ ]A.乙池中d的电极反应为 B.a,c两极产生气体的物质的量相等 C.甲、乙两池中
某同学按下图所示的装置进行电解实验.下列说法正确的是 [ ]A.电解过程中 铜电极上有H
某同学按下图所示的装置进行电解实验.下列说法正确的是 [ ]A.电解过程中,铜电极上有H2产生 B.电解初期,主反应方程式为:Cu+H2SO4CuSO4+H2↑ C.
能够实现反应Cu+2H2O===Cu(OH)2↓+H2↑的是[ ]A.铜银合金在潮湿空气中发
能够实现反应Cu+2H2O===Cu(OH)2↓+H2↑的是[ ]A.铜银合金在潮湿空气中发生电化学腐蚀 B.用铜片作阴极、石墨作阳极,电解饱和氯化钠溶液 C.用铜片
用石墨作电极 电解1摩/升下列物质的溶液 溶液的pH值保持不变的是( )A.HClB.NaOHC.
用石墨作电极,电解1摩 升下列物质的溶液,溶液的pH值保持不变的是( )A.HClB.NaOHC.Na2SO4D.NaCl












