如图装置实验 A B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后 c极上
| 如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发). 请回答下列问题: (1)电源P极为______极;请分别写出b极和c极上发生的电极反应式:______;______ (2)c极上析出固体铜的质量为______g (3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应: 负极:Pb+SO42-=PbSO4+2e- 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O 假设在a极制得气体0.050mol,这时电池内消耗的H2SO4的物质的量至少是______mol. 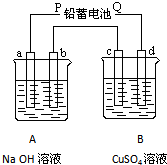 |
参考解答
| (1)c极上有Cu析出,说明c为电解池的阴极,d为阳极,则P为负极,b为电解NaOH溶液的阳极发生反应为4OH--4e-=2H2O+O2↑,c为电解硫酸铜溶液的阴极,发生反应为Cu2++2e-=Cu, 故答案为:负;4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu; (2)A总反应式为2H2O
故答案为:16; (3)a极制得气体0.050mol,因为氢气,转移电子0.10mol,铅蓄电池总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,则电池内消耗的H2SO4的物质的量至少是0.10mol, 故答案为:0.10. |
相似问题
金属镍有广泛的用途.粗镍中含有少量Fe Zn Cu Pt等杂质 可用电解法制备高纯度的镍 下列叙述正
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A.阳
下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是[ ]A.该流程图中只存在
下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是[ ]A.该流程图中只存在4种形式的能量转化 B.装置X中阳极反应式为:2H2O-4e-=4H
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子
加碘食盐中含有碘酸钾(KIO3) 现以电解法制备碘酸钾 实验装置如图所示。先将一定量的碘溶于过量氢氧
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该
下图为直流电源 为浸透饱和氯化钠溶液和酚酞试液的滤纸 为电镀槽 接通电路后发现上的c点显红色.为实现
下图为直流电源,为浸透饱和氯化钠溶液和酚酞试液的滤纸,为电镀槽、接通电路后发现上的c点显红色.为实现铁上镀锌,接通后,使c、d两点短路.下列叙述正












