工业废水中常含有一定量的Cr2O72-和CrO42- 它们会对人类及生态系统产生很大损害 必须进行处
| 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。 方法1:还原沉淀法该法的工艺流程为: |
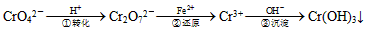 |
其中第①步存在平衡:2CrO42-(黄色)+2H+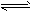 Cr2O72-(橙色)+H2O Cr2O72-(橙色)+H2O⑴若平衡体系的pH=2,该溶液显________色。 ⑵能说明第①步反应达平衡状态的是________。 a. Cr2O72-和CrO42-的浓度相同 b. 2v(Cr2O72-)=v(CrO42-) c. 溶液的颜色不变 ⑶第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。 ⑷第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 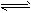 Cr3+(aq)+3OH-(aq) 常温下, Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。 方法2:电解法该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。 ⑸用Fe做电极的原因为___________________。 ⑹在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________,溶液中同时生成的沉淀还有______________。 |
参考解答
| ⑴橙 ⑵c ⑶6 ⑷5 ⑸阳极反应为Fe-2e-==Fe2+,提供还原剂Fe2+ ⑹2H++2e-==H2↑;Fe(OH)3 |
相似问题
(1)A B C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。①B中Sn极的电极反应式为_______
(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。①B中Sn极的电极反应式为___________,Sn极附近溶液的pH(填“增大”.“减小”或“不变”)_____
用含少量银和锌的粗铜做阳极 纯铜片做阴极 CuSO4溶液做电解液 电解一段时间后 阳极质量减少了x
用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则 [ ]A.电解液质量增加x gB.阴极质量增加x
按下图所示装置进行实验 并回答下列问题: (1)判断装置的名称:A池为____ B池为____。 (
按下图所示装置进行实验,并回答下列问题: (1)判断装置的名称:A池为____,B池为____。 (2)锌极为____极,电极反应式为____;铜极为_____极,电极反应
将质量相等的铜片和铂片插入硫酸铜溶液中 铜片与电源正极相连 铂片与电源负极相连 以电流强度1A通电1
将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连,铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min
下图是一个化学过程的示意图 回答下列问题:(1)甲电池是________ 装置 乙池是_______
下图是一个化学过程的示意图,回答下列问题:(1)甲电池是________ 装置,乙池是_______________ 装置。 (2)通入CH3OH的电极名称是______________












