下图所示装置中 甲 乙 丙三个烧杯依次分别盛放100g5 00%的NaOH 溶液 足量的CuSO4溶
| 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5 00%的NaOH 溶液、足量的CuSO4溶液和l00g10. 00%的K2SO4溶液,电极均为石墨电极。 |
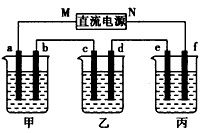 |
| 接通电源,经过一段时间后,测得丙中K2SO4浓度为10. 47%,乙中c电极质量增加。据此回答问题: (1)①电源的N端为_______极; ②电极b上发生的电极反应为______________; ③列式计算电极b上生成的气体在标准状况下的体积:___________________; ④电极c的质量变化是______________g; (2)电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液_________________________; 乙溶液_________________________; 丙溶液__________________________; (3)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? ___________________________________________________ 。 |
参考解答
| (1)正;4OH--4e-=2H2O+O2↑;2.8L;l6 (2)碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大;酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加;酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性 (3)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应 |
相似问题
现有用离子交换膜和石墨作电极的电解槽 电解饱和Na2SO4溶液生产NaOH和H2SO4 下列说法中正
现有用离子交换膜和石墨作电极的电解槽,电解饱和Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是[ ]A.气体A是H2,溶液E是稀硫酸B.气体B是H2,溶液D是
如图 X和Y均为石墨电极。 (1)若电解液为滴有酚酞的饱和食盐水 电解反应的离子方程式为______
如图,X和Y均为石墨电极。 (1)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为__________________________;电解过程中____________极(填“
某溶液中含有两种溶质NaCl和H2SO4 它们的物质的量之比为3∶1。滴入几滴石蕊溶液后 用石墨作电
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1。滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个
甲醇是一种可再生能源 具有开发和应用的广阔前景 工业上一般可采用如下反应来合成甲醇:CO(g)+2H
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)CH3OH(g)。(1)分析该反应并回答下列问题: ①
如图所示 X Y分别为外接直流电源的两极 a b是石墨电极 通电一段时间后 a极附近溶液显红色。回答
如图所示,X、Y分别为外接直流电源的两极,a、b是石墨电极,通电一段时间后,a极附近溶液显红色。回答下列问题 (1)Y的电极名称是____________;Cu电极












