迄今为止 由化学能转变的热能或电能仍然是人类使用的主要的能源。I.请仔细观察下列两种电池的构造示意图
| 迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。 I.请仔细观察下列两种电池的构造示意图,完成下列问题: 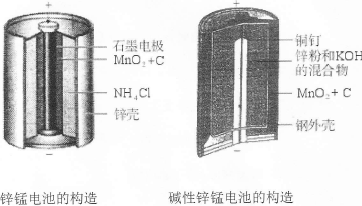 (1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。 (2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。 Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题: 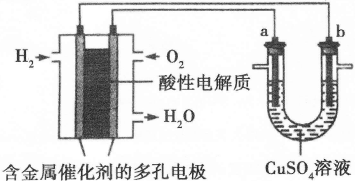 (1)写出通入O2一极的电极反应方程式为 。 (2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。 (3)下列说法不正确的是( )
 |
参考解答
| I.(1)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大(2分) (2)Zn+2OHˉ—2eˉ=Zn(OH)2(2分) Ⅱ.(1)O2+4e—+4H+=2H2O(2分) (2)阳(1分) 不能(1分),因为a电极的电极材料不确定,所以不能写出其电极反应方程式(2分) (3)BC(2分) Ⅲ.(2分。图正确1分,标注1分) 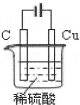 |
试题分析:I.(1)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大;(2)由电池工作环境、电子、电荷、原子守恒可知,正极反应式为2MnO2+2H2O+2eˉ=2MnOOH+2OHˉ,负极反应式为Zn+2OHˉ—2eˉ=Zn(OH)2;II.(1)由酸性条件、电子、电荷、原子守恒可知,正极反应式为O2+4e—+4H+=2H2O,负极反应式为2H2+4e—=4H+;(2)与燃料电池的正极相连,则a是电解池的阳极;由于不能确定阳极材料是否是惰性电极,因此不能写出阳极反应式;(3)A、电镀铜时,阳极反应式为Cu—2e—=Cu2+,阴极反应式为Cu2++2—=Cu,电镀液中Cu2+不变,正确;B、a是惰性电极时,OH—在a极上放电,若a是Cu等活性电极时,OH—不能在a极上放电,错误;C、粗制金属的电解精炼时,纯金属作阴极,粗制金属作阳极,错误;D、外电路中,电子从负极流出,经过导线流入阴极,正确;III.画图要点:铜与稀硫酸不能自发地反应,因此只能设计为电解池;铜元素由0价升高为+2价,发生氧化反应,则Cu一定是阳极,与直流电源的正极相连;可用石墨等导体作阴极,稀硫酸作电解液,H+移向阴极,并在阴极上发生还原反应,生成氢气。 |
相似问题
全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道 使其免受腐蚀。关
全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是A.土壤中的钢铁
据环保部门测定 我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀 则在其腐蚀中负极主要发生
据环保部门测定,我国一些大城市的酸雨pH=3 5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中负极主要发生的反应是A.2H++2e-=H2↑B.2H2O+O2+4e-=4OH-C.Fe-2
有关电化学原理的推断正确的是A.金属腐蚀就是金属原子失去电子被还原的过程B.钢铁吸氧腐蚀时 负极反应
有关电化学原理的推断正确的是A.金属腐蚀就是金属原子失去电子被还原的过程B.钢铁吸氧腐蚀时,负极反应式为:2H2O+O2+4e→4OH-C.氯碱工业中,阳极发生
不能用Fe+H2SO4=FeSO4+H2↑表示的是( )A.用导线将铁片和铜片连接后 放入一
不能用Fe+H2SO4=FeSO4+H2↑表示的是( )A.用导线将铁片和铜片连接后,放入一盛有稀 H2SO4溶液的烧杯中B.将铁片直接放入一盛有稀 H2SO4溶液的烧杯中C
微电解技术具有处理效果显著 投资少 运行费用低等优点。铝碳微电解处理就是利用铝-碳颗粒之间形成了无数
微电解技术具有处理效果显著、投资少、运行费用低等优点。铝碳微电解处理就是利用铝-碳颗粒之间形成了无数个细微原电池,这些细微电池在酸性溶液中发生












