(13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。元素ABCD性质结构信息原子
(13分) 四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其是__________________________。 ⑶D的最高价氧化物的电子式: 。高温下D的氧化物还原赤铁矿的方程式为可逆反应,写出该反应的化学方程式___________________,该反应的平衡常数表达式K=___________。 ⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________________,简要描述该配合物中化学键的成键情况__________________。 ⑸下列分子结构图中的“  ”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“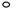 ”表示氢原子,小黑点“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。 ”表示没有形成共价键的最外层电子,短线表示共价键。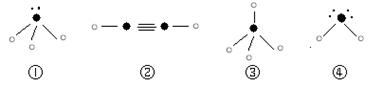 则在以上分子中,中心原子采用sp3杂化形成化学键的且空间构型是角形的是 (填写序号);在②的分子中有 个σ键和 个π键。 ⑹已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 /s/up10(∣←N-,/s/up10(∣H(→表示共用电子对由N原子单方面提供)。 请画出N4H44+的结构式_____________________。 |
参考解答
| ⑴ 1s22s22p63s23p4 (1分) ⑵高,因为A的氢化物存在氢键(各1分) ⑶ 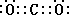 Fe2O3(s) + 3CO(g) Fe2O3(s) + 3CO(g)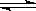 2Fe(s) + 3CO2(g) K=C3(CO2)/ C3(CO)(各1分) 2Fe(s) + 3CO2(g) K=C3(CO2)/ C3(CO)(各1分)⑷[Cu(NH3)4SO4(1分),中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合(1分)⑸ ④(1分)3 (1分) 2(1分) ⑹ 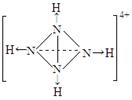 (2分) (2分) |
试题分析:B原子的M层有1对成对的p电子,说明M层电子数是4,所以B原子的电子排布式1s22s22p63s23p4 ;, A原子核外有两个电子层,最外层有3个未成对的电子所以A原子L层电子数是5即是N原子,A元素的氢化物的沸点比同主族相邻元素氢化物沸点高,因为A的氢化物存在氢键; D有两种常见氧化物,其中有一种是冶金工业常用的还原剂,是CO所以D的最高价氧化物的电子式 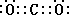 ,高温下D的氧化物还原赤铁矿的方程式为可逆反应,该反应的化学方程式Fe2O3(s) + 3CO(g) ,高温下D的氧化物还原赤铁矿的方程式为可逆反应,该反应的化学方程式Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) ; 该反应的平衡常数表达式K=C3(CO2)/ C3(CO) ;C原子核外电子排布为[Ar3d104s1,有+1、+2两种常见化合价 2Fe(s) + 3CO2(g) ; 该反应的平衡常数表达式K=C3(CO2)/ C3(CO) ;C原子核外电子排布为[Ar3d104s1,有+1、+2两种常见化合价所以C原子时Cu,C元素的硫酸盐溶液是硫酸铜溶液,逐滴加入过量A元素的氢化物水溶液是氨水,可生成的配合物的化学式为[Cu(NH3)4SO4,该配合物中化学键的成键情况是中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合;中心原子采用sp3杂化形成化学键的且空间构型是角形的是 ④;在②的分子中有3个σ键和 2个π键;已知NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为 \s\up10(∣←N-,\s\up10(∣H ;N4H44+的结构式是 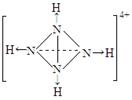 点评:对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),然后将电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个。最外层电子到底怎样排布,还要参考洪特规则 洪特规则 从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于全满(s2、p6、d10、f14)半满(s1、p3、d5、f7)全空(s0、p0、d0、f0)时比较稳定。 配位键:一个原子提供一对电子与另一个接受电子的原子形成的共价键.即成键的两个原子一方提供孤对电子,一方提供空轨道而形成的共价键。 (2)①.配合物:由提供孤电子对的配位体与接受孤电子对的中心原子(或离子)以配位键形成的化合物称配合物,又称络合物。 ②形成条件:a.中心原子(或离子)必须存在空轨道. b.配位体具有提供孤电子对的原子。 ③配合物的组成。 ④配合物的性质:配合物具有一定的稳定性.配合物中配位键越强,配合物越稳定.当作为中心原子的金属离子相同时,配合物的稳定性与配体的性质有关。 |
相似问题
在空气中不易变质的是A.Na2SO3B.NaHSO4C.亚硫酸D.氢硫酸
在空气中不易变质的是A.Na2SO3B.NaHSO4C.亚硫酸D.氢硫酸
下列物质中只存在ss型σ键的是( )A.H2B.CH4C.NH3D.N2
下列物质中只存在ss型σ键的是( )A.H2B.CH4C.NH3D.N2
(6分)Q W X Y Z为5种短周期元素 且原子序数依次增大。W X与Y同周期 Y与Z同主族。Q与
(6分)Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大。W、X与Y同周期,Y与Z同主族。Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个
用价电子对互斥理论预测H2S和BF3的空间构型 两个结论都正确的是( )A.直线形;三角锥形B.V
用价电子对互斥理论预测H2S和BF3的空间构型,两个结论都正确的是( )A.直线形;三角锥形B.V形;三角锥形C.直线形;平面三角形D.V形;平面三角形
下列说法不正确的是A.不是所有的共价键(σ 键)都具有方向性B.N≡N键能大于C≡C的键能 所以N≡
下列说法不正确的是A.不是所有的共价键(σ 键)都具有方向性B.N≡N键能大于C≡C的键能,所以N≡N不易发生加成反应C.根据价层电子对互斥理论可知,OF












