(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数 Y为元素的有关性质).请把与下面
(1)下列曲线分别表示元素的某种性质与该电荷数的关系(Z为该电荷数,Y为元素的有关性质). 请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中: ①ⅡA族元素的最外层电子数______. ②第3周期元素的最高化合价______. ③F-、Na+、Mg2+、Al3+的离子半径______. (2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子的最外层电子数与次外电子数之比为3:4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答: ①N的最高价氧化物的水化物的化学式是______. ②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度最小,则化合物A中的化学键类型为______,若B为常见家用消毒剂的主要成分,则B的化学式是______. ③Z与M形成的稳定固体化合物的电子式为______. ④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成一种单质的化学方程式______,可观察到的实验现象是______. |
参考解答
| (1)①价电子数=最外层电子数=族序数,故ⅡA元素的价电子数为2,故选b;②元素的最高正价=最外层电子数=族序数,第3周期元素最高化合价从左到右逐渐升高,故选c;③核外电子数相同,则核内质子数越多半径越小,所以离子半径为:F->Na+>Mg2+>Al3+,故选a; 故答案为:①b ②c ③a (2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为S,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢, ①氯的最高价氧化物的水化物的化学式是 HClO4,故答案为:HClO4 ②由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小,则A为氢氧化钠,B为次氯酸钠,氢氧化钠中含有离子键、共价键,故答案为:离子键、共价键; NaClO; ③Z为钠,M为S,Z与M形成的稳定固体化合物为硫化钠,故答案为: 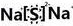 ④X与Y形成的18电子化合物为H2O2,X与M形成的18电子化合物为H2S,二者反应生成硫单质淡黄色沉淀,故答案为:H2O2+H2S=S↓+2H2O,无色溶液中产生淡黄色浑浊 |
相似问题
元素性质呈周期性变化的本质是( )A.元素原子半径大小呈周期性变化B.元素的相对原子质量依次递增C
元素性质呈周期性变化的本质是( )A.元素原子半径大小呈周期性变化B.元素的相对原子质量依次递增C.元素原子核外电子排布呈周期性变化D.元素的最
几种短周期元素的原子半径及主要化合价如下表:元素代号XYZW原子半径/pm1601437066主要化
几种短周期元素的原子半径及主要化合价如下表:元素代号XYZW原子半径 pm1601437066主要化合价+2+3+3、+5、-3-2下列叙述正确的是( )A.X、Y元素的金
短周期主族元素A B C D的原子序数依次增大 A与D同主族 B与C在同一周期 B原子最外层电子数比
短周期主族元素A、B、C、D的原子序数依次增大,A与D同主族,B与C在同一周期,B原子最外层电子数比C原子少2个,A、C单质在常温下均为气体,它们在一定条件
1~18号元素中 原子核外电子层数等于最外层电子数的元素共有( )A.1种B.2种C.3种D.4种
1~18号元素中,原子核外电子层数等于最外层电子数的元素共有( )A.1种B.2种C.3种D.4种
某元素的最高正化合价与最低负化合价的代数和为4 则该元素原子的最外层电子数为( )A.4B.5C.
某元素的最高正化合价与最低负化合价的代数和为4,则该元素原子的最外层电子数为( )A.4B.5C.6D.7












