五种短周期元素的部分性质数据如下:元素TXYZW原子半径(nm)0.0370.0750.0990.1
五种短周期元素的部分性质数据如下:
(2)关于Y、Z两种元素,下列叙述正确的是______(填序号). a.简单离子的半径 Y>Z b.气态氢化物的稳定性Y比 Z强 c.最高价氧化物对应水化物的酸性Z比Y强 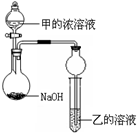 (3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物. 某同学设计了右图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是______.一段时间后,发生反应的离子方程式是______. (4)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为______. |
参考解答
(1)由Z为短周期元素,其化合价为+6、-2,则Z为硫,其质子数为16,硫离子带2个单位的负电荷,则最外层电子数为8,故答案为: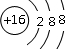 ; (2)由Y的化合价及Y为短周期元素,则Y为Cl,氯离子半径小于硫离子半径,则a错;氯比硫元素的非金属性强,则HCl的稳定性强于H2S,则b对; 氯比硫元素的非金属性强,则高氯酸的酸性大于硫酸的酸性,则C错,故答案为:b; (3)由表中的化合价及元素都在短周期,T、X两种元素形成的10e-分子,T为H元素,W为Al元素,则甲为氨气,乙为氯化铝,由图可知,烧瓶中发生氨水与氢氧化钠的反应制取氨气,试管中发生氯化铝与氨水的反应生成沉淀,制取氨气的原理为NH3+H2O  NH3?H2O  NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小,试管中的反应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:NH3+H2O  NH3?H2O  NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小;Al3++3NH3?H2O=Al(OH)3↓+3NH4+; (4)由X的化合价可知X为第ⅤA族元素,XO2是导致光化学烟雾的“罪魁祸首”之一,则X为N元素,再由2XO2+2NaOH=M+NaXO3+H2O可知,NO2中N元素的化合价+4价,NaNO3中N元素的化合价为+5价,由氧化还原反应中得失电子守恒可知M中N的化合价为+3价,故答案为:+3. |
相似问题
A B C D E F六种短周期元素的原子序数依次增大 已知:①A原子核内只有1个质子;②B原子最外
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次
X Y均为元素周期表中前20号元素 其简单离子的电子层结构相同 下列说法正确的是( )A.由mXa
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )A.由mXa+与nYb-,得m+a=n-bB.X2-的还原性一定大于Y-C.X、Y一
A B C D E F六种短周期元素的原子序数依次增大 已知:①A原子核内只有1个质子;②B原子最外
A、B、C、D、E、F六种短周期元素的原子序数依次增大,已知:①A原子核内只有1个质子;②B原子最外层电子数是次外层电子数的2倍;③C原子最外层电子数比次
现有部分短周期元素的性质或原子结构如下表:元素编号元素性质或原子结构T能形成双原子分子 原子间存在3
现有部分短周期元素的性质或原子结构如下表:元素编号元素性质或原子结构T能形成双原子分子,原子间存在3对共用电子对XM层有3个电子Y最外层电子数是最内
A B C D E F六种短周期主族元素 原子序数依次增大.其中B的单质在常温下为双原子分子 它与A
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与












