短周期主族元素A B C D E F的原子序数依次增大 它们的原子核外电子层之和为13;B的化合物种
| 短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层之和为13;B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素;D、E形成的单质在不同条件下可以生成两种不同的离子化合物;F是同周期元素中原子半径最小的. (1)A、D以1:1形成化合物的电子式为______.A、C形成最简单化合物的空间构型为______.B可形成晶体类型不同的多种单质,它们互称为______. (2)A、C形成的某化合物的相对分子质量与D2的相等,写出该化合物与足量盐酸反应的离子方程式:______. (3)A、C、F形成的化合物是一种常见的化学肥料,该物质的水溶液中离子浓度的大小顺序为______. (4)C、D两元素可组成价态相同且能相互转变的化合物,它们是______(填化学式). (5)F2与FD2均可用于自来水的杀菌消毒,若它们在杀菌过程中的还原产物相同,则消毒等体积的自来水,所需F2和FD2的物质的量之比为______. |
参考解答
| B的化合物种类繁多,数目庞大,则B为C元素,能形成多种化合物,C、D是空气中含量最多的两种元素,又D的原子序数大于C,则C为N元素,D为O元素,D、E形成的单质在不同条件下可以生成两种不同的离子化合物,则E为Na元素,可分别形成Na2O、Na2O2,F是同周期元素中原子半径最小的,应为Cl元素,A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层之和为13,则A的原子核外电子层数为13-2-2-2-3-3=1,则A为H元素, (1)A、D以1:1形成化合物为H2O2,电子式为 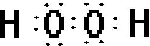 ,A、C形成最简单化合物为NH3,空间构型为三角锥形,由同种元素形成的不同单质为同素异形体, 故答案为: 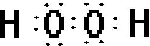 ;三角锥形;同素异形体; (2)O2的相对分子质量为32,与之相对分子质量相等的N、H化合物为N2H4, 与盐酸反应的离子方程式为N2H4+2H+=N2H62+,故答案为:N2H4+2H+=N2H62+; (3)A、C、F形成的化合物为NH4Cl,为强酸弱碱盐,水解呈酸性,溶液中的离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-), 故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-); (4)C、D两元素可组成价态相同且能相互转变的化合物为NO2和N2O4,存在2NO2  N2O4,故答案为:NO2和N2O4; (5)Cl2与ClO2均可用于自来水的杀菌消毒,若它们在杀菌过程中的还原产物相同,则反应中得到电子的物质的量相等,则有2n(Cl2)×(0-(-1))=n(ClO2)×(4-(-1)),所以n(Cl2):n(ClO2)=5:2, 故答案为:5:2. |
相似问题
A元素原子L层比B元素L层少2电子 B元素核外电子数比A元素多5个 则A B可形成( )A.ABB
A元素原子L层比B元素L层少2电子,B元素核外电子数比A元素多5个,则A、B可形成( )A.ABB.A2BC.A2B3D.B2A3
下列化学用语使用不正确的是 [ ]A.Na+的结构示意图 B.纯碱的化学式为Na2CO3C.
下列化学用语使用不正确的是 [ ]A.Na+的结构示意图 B.纯碱的化学式为Na2CO3C.聚乙烯的结构简式为CH2=CH2 D.高氯酸(HClO4)中氯元素的化合价为+7
第四周期过渡元素Mn Fe Ti可与C H O形成多种化合物.(1)下列叙述正确的是______.(
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是______.(填字母)A.CH2O与水分子间能形成氢键B.CH2O和CO2分子中的中心
A B C三种短周期元素 A B同周期 A C的最低价离子分别为A2-和C- 离子半径A2->C-;
A、B、C三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-和C-,离子半径A2->C-;B2+与C-离子具有相同电子结构,下列说法不正确的是( )A.原
几种短周期元素的原子半径及主要化合价见下表:元素符号ABCDE原子半径(nm)0.1600.080X
几种短周期元素的原子半径及主要化合价见下表:元素符号ABCDE原子半径(nm)0 1600 080X0 1430 074主要化合价+2+2-2,+4,+6+3-2则X可能的数值为( )












