A B C D E分别属于周期表中前20号元素 其原子序数依次递增 并且其中只有一种金属元素.A是元
| A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍; D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等. 请按要求回答下列问题: (1)画出E 的离子结构示意图______,写出由A 和C 组成的含有非极性键的化合物的电子式______. (2)由上述元素组成的化合物中属于极性键构成的非极性分子是______. (只要求写出两种,用化学式表示) (3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式______ (4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:______ (5)上述元素形成的化合物中通常能污染空气的是______ (至少写出两种).某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为:______. |
参考解答
| A是元素周期表所有元素中原子半径最小的,则A为H元素;E核外各层电子数两两相等,则E为Ca元素. A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.B中一层电子数是另一层的两倍,则B为C元素;C 中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素. 即A为H元素;B为C元素;C为O元素;D为S元素;E为Ca元素. (1)E为Ca元素,Ca2+核内质子数为20,核外18个电子,有3个电子层,最外层有8个电子,离子结构示意图为 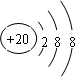 . A和C组成的含有非极性键的化合物是H2O2,过氧化氢电子式为 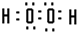 . 故答案为:  ; 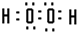 . (2)上述元素组成的化合物中属于极性键构成的非极性分子有CH4、CO2、CS2. 故答案为:CH4、CO2、CS2. (3)由C与E形成的化合物为CaO,高温时与碳反应生成CaC2和CO,反应方程式为CaO+3C
故答案为:CaO+3C
(4)上述元素组成的可溶性盐为醋酸钙,强酸为硫酸,反应离子方程式为Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓. 故答案为:Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓. (5)上述元素形成的化合物中通常能污染空气的是CO、SO2、H2S 等; 臭氧具有强氧化性,硫化氢具有较强的还原性,二者发生反应 H2S+O3=SO2+H2O. 故答案为:CO、SO2、H2S 等;H2S+O3=SO2+H2O. |
相似问题
几种短周期元素的原子半径及主要化合价如表所示:元素符号XYZRT原子半径(mm)0.1600.080
几种短周期元素的原子半径及主要化合价如表所示:元素符号XYZRT原子半径(mm)0 1600 0800 1020 1430 074主要化合价+2+2-2、+4、+6+3-2根据表中信息,判
A与B两种元素的原子 当它们分别获得1个电子形成稀有气体原子的电子层结构时 A放出的能量大于B.下列
A与B两种元素的原子,当它们分别获得1个电子形成稀有气体原子的电子层结构时,A放出的能量大于B.下列叙述中正确的是( )A.A的氧化性小于BB.A的氢
某元素R原子的核电荷数是电子层数的5倍 其质子数是最外层电子数的3倍 该元素氢化物的化学式是( )
某元素R原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素氢化物的化学式是( )A.HRB.H2RC.RH3D.RH4
X Y Z W是分别位于第2 3周期的元素 原子序数依次递增.X与Z位于同一主族 Y元素的单质既能与
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次
下列说法中错误的是( )A.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等B
下列说法中错误的是( )A.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等B.元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金












