已知X Y Z W四种元素是元素周期表中连续三个短周期的元素 且原子序数依次增大.X W同主族 Y
| 已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的核外电子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断: (1)X、Z二种元素的元素符号:X______;Z______. (2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为______、______、______. (3)由X、Y、Z所形成的常见离子化合物是______,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式______. (4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是______. |
参考解答
| X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.Z原子最外层电子数是次外层电子数的3倍,则Z有2个电子层,最外层电子数为6,故Z为氧元素;Y、Z为同周期的相邻元素,原子序数Y小于Z,故Y为氮元素;W原子的核外电子数等于Y、Z原子最外层电子数之和,故W的核外电子数为5+6=11,故W为钠元素;X、W同主族,四种元素是元素周期表中连续三个短周期的元素,故X为氢元素. 故X为氢元素、Y为氮元素、Z为氧元素、W为钠元素. (1)由上述分析可知,X为H;Z为O. 故答案为:H;O. (2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物为氨气、氧化钠、过氧化钠等.电子式分别为 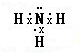 、  、 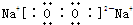 . 故答案为: 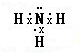 、  、 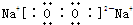 . (3)X为氢元素、Y为氮元素、Z为氧元素,三元素形成的常见离子化合物是NH4NO3;W为钠元素,W的最高价氧化物的水化物为NaOH,NH4NO3与NaOH浓溶液热时反应生成氨气与水,溶液离子方程式为NH4++OH-
故答案为:NH4NO3;NH4++OH-
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,可以形成分子晶体,如水;可以形成离子晶体,如NaOH;可以形成金属晶体,如钠.不能形成的晶体类型是原子晶体. 故答案为:原子晶体. |
相似问题
胃舒平主要成分是氢氧化铝 同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。 (1)三硅酸镁的
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。 (1)三硅酸镁的氧化物形式为____,某元素与镁元素不同周期但在相邻一族,且
A B C D E五种短周期元素 原子序数E>D>A>B>C 且A B D E同周期 A C同主族
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的
科学研究证明:核外电子的能量不仅与电子所处的能层 能级有关 还与核外电子的数目及核电荷的数目有关。氩
科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是1s22s22
具有如下电子层结构的原子 其相应元素一定属于同一主族的是 [ ]A.3p能级上有2个未成对电
具有如下电子层结构的原子,其相应元素一定属于同一主族的是 [ ]A.3p能级上有2个未成对电子的原子和4p能级上有2个未成对电子的原子 B.3p能级上只有1
元素X的原子核外第三层上有3个电子 元素Y的负二价离子离子核外有10个电子 则这两种元素形成化合物的
元素X的原子核外第三层上有3个电子,元素Y的负二价离子离子核外有10个电子,则这两种元素形成化合物的化学式为( )A.XY2B.X2YC.X2Y3D.X3Y2












