(12分)硫酸铜是一种重要的化工原料 工业上常用硫酸为原料来制备硫酸铜。(1)工业上生产硫酸过程中
| (12分)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。 (1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。 ①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。 ②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。 (2)测定硫酸铜品体中结品水含量的实验步骤为: 步骤1:准确称量一个洁净、干燥的坩埚; 步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重 步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热; 步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重: 步骤5: ; 步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。 请完成实验步骤5。 (3)已知硫酸铜品体受热可以逐步失去结品水,温  度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示: 度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示: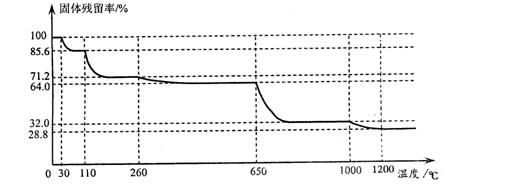 在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所  得气态产物除去水后,物质的量为 。(填字母) 得气态产物除去水后,物质的量为 。(填字母)
|
参考解答
| (12分,每空2分) (1)①3Fe2O3+CO  CO太多导致Fe3O4还原为铁,CO太少Fe2O3没有全部转化成Fe3O4 ②CaCl2+SiO2+H2O  (2)将步骤4中的坩埚再加热一定时间,放入干燥器中冷却至室温后称越。重复本操作,直至两次称量结果不变; (3)CuSO4·3H2O,D |
| 略 |
相似问题
有关晶体的下列说法中正确的组合是①晶体中分子间作用力越大 分子越稳定 ②.原子晶体中共价键越强 熔点
有关晶体的下列说法中正确的组合是①晶体中分子间作用力越大,分子越稳定②.原子晶体中共价键越强,熔点越高③冰熔化时水分子中共价键发生断裂④.氯化
下面关于SiO2晶体网状结构的叙述正确的是A.存在四面体结构单元 O处于中心 Si处于4个顶角B.最
下面关于SiO2晶体网状结构的叙述正确的是A.存在四面体结构单元,O处于中心,Si处于4个顶角B.最小的环上,有3个Si原子和3个O原子C.最小的环上,Si和O原
二氧化硅晶体中 每个硅原子周围有_________个氧原子 每个氧原子周围有_________个硅原
二氧化硅晶体中,每个硅原子周围有_________个氧原子,每个氧原子周围有_________个硅原子,硅氧原子个数比为_________。若去掉二氧化硅晶体中的氧原子,
下列说法正确的是( )A.两种元素组成的分子中一定只有极性键B.原子晶体中共价键
下列说法正确的是( )A.两种元素组成的分子中一定只有极性键B.原子晶体中共价键越强,熔点越高C.晶体中分子间作用力越大,分子越稳定D.由极性共价键
(15分)[物质结构与性质] I . 固体二氧化碳外形似冰 受热汽化无液体产生 俗称“干冰” 根据干
(15分)[物质结构与性质] I 固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答:(1)干冰中一个分子周围有________












