《物质结构与性质》19-1.(6分 该题为多项选择题 全选对得6分 漏选按比例给分 错选或多选为0分
| 《物质结构与性质》 19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。 (3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。 (4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。 (5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。 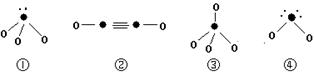 则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。 |
参考解答
| 19-1(6分)ACE 19-2(14分) (1)1s22s22p63s23p4(2分) (2)高(1分) 因为A的氢化物分子间存在氢键(1分) (3)低(1分) 晶体类型不同(1分) (4)[Cu(NH3)4SO4(2分) 中心原子与配体之间以配位键相结合,内界与外界之间以离子键相结合(2分) (5)①③④(2分) 3(1分) 2(1分) |
| 略 |
相似问题
(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一 试回答下列问题:Ⅰ. 二氧化钛作光催
(12分)过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:Ⅰ 二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二
下列物质在固态时是原子晶体的是( )A.二氧化硅B.硝酸铵C.磷酸D.蔗糖
下列物质在固态时是原子晶体的是( )A.二氧化硅B.硝酸铵C.磷酸D.蔗糖
(10分)由阴阳离子通过离子键结合而成的晶体称为离子晶体 离子化合物固态时一般为晶体 在离子晶体中
(10分)由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。下图是NaCl晶
Q R X Y为前20号元素中的三种 Y22+ Q的低价氧化物都与X单质分子均为等电子体 R与Q同族
Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。⑴Q的最高价氧化物,其固体属于晶体,比较Q、X、Y 第一电
下列说法正确的是A.有些晶体是由分子直接构成的 如干冰 白磷等;有些晶体是由原子直接构成的 如金刚石
下列说法正确的是A.有些晶体是由分子直接构成的,如干冰、白磷等;有些晶体是由原子直接构成的,如金刚石、重晶石等;有些晶体是由离子直接构成的,如食












