下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:根据元素的主要化合价和原子半径可知
| 下表列出了前20号元素中的某些元素性质的有关数据: 试回答下列问题: 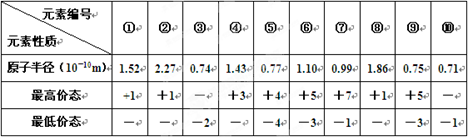 根据元素的主要化合价和原子半径可知,①~⑩分别是Cl、K、O、Al、C、P、Na、N、F。 (1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。 (3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。 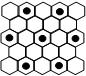 |
参考解答
⑴ ② ⑵PCl3或CCl4 第三周期、ⅥA族 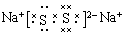 ⑶ KC8 ⑶ KC8 |
试题分析: (1)金属性越强,则第一电离能越小,所以10种元素的原子中,失去核外第一个电子所需能量最少的是K,即是②。 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3或CCl4。同周期自左向右原子半径逐渐减小,自上而下原子半径逐渐最大,所以某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期、ⅥA族。该化合物的电子式类似于过氧化钠,所以电子式是 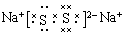 。 。(3)根据结构示意图可知,晶胞中K原子的个数是3×1/6=0.5个,而碳原子的个数是84个,所以该化合物的化学式是KC8。 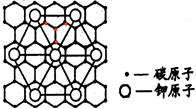 点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生灵活运用基础知识解决实际问题的能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。 |
相似问题
有一种蓝色晶体[可表示为:MFey(CN)6] 经X射线研究发现 它的结构特征是Fe3+ 和Fe2+
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+ 和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中
在一定温度下 向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3 搅拌后静置 最终得到晶体
在一定温度下,向足量的饱和Na2CO3溶液中加入1 06g无水Na2CO3,搅拌后静置,最终得到晶体的质量为A.等于1 06gB.大于 1 06g 而小于2 86gC.等于2 86gD.大于2 86g
下列说法中正确的是( )A.水被冷却到00C以下时变成冰 是因为水分子从液体变成了固体B.所有物质
下列说法中正确的是()A.水被冷却到00C以下时变成冰,是因为水分子从液体变成了固体B.所有物质在温度变化时都能表现出三态变化C.不降低温度,只增大
(8分)某离子晶体晶胞结构如图所示 X位于立方体的顶点 Y位于立方体的中心 试回答:(1)晶体中每个
(8分)某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心,试回答:(1)晶体中每个Y同时吸引着个X,每个X同时吸引着个Y,该晶体的化
下列各组物质的晶体中 化学键类型相同 晶体类型也相同的是( )A.SO2和SiO2B.NaCl和
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是()A.SO2和SiO2B.NaCl和HClC.CCl4和KClD.NH3和H2O












