(1)如图1 A B C三个实验用于验证质量守恒定律:①实验C中 烧杯中看到的现象是______;②
(1)如图1,A、B、C三个实验用于验证质量守恒定律: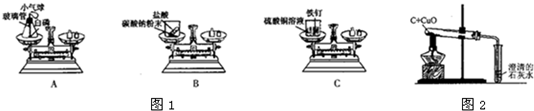 ①实验C中,烧杯中看到的现象是______; ②其中不能达到实验目的是______,理由是______. (2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题: ①写出用木碳还原氧化铜的化学方程式:______; ②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤. a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是______,说明试管中的剩余固体为______; b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是______. (3)如图是探究酸碱中和的实验: 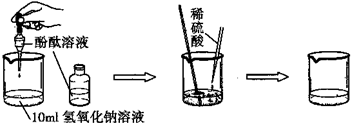 小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
②请分析错误方案的原因:______. |
参考解答
| (1)①铁能置换出硫酸铜中的铜,因此实验C中,烧杯中看到的现象是铁钉表面变成红色; 故答案为:铁钉表面变成红色; ②用图A中的装置进行验证质量守恒定律,能达到目的,原因在于装置是密封的; 图B不能达到目的,因为生成的二氧化碳气体逸散到空气中去了; 图C也能达到目的,因为生成物和反应物中都没有气体产生; 故答案为:B; 生成的二氧化碳气体逸散到空气中去了; (2)①木炭与氧化铜在高温下反应生成铜和二氧化碳,化学方程式为:C+2CuO
②a、铜、碳和稀硫酸不反应,氧化铜与稀硫酸反应,滤纸上留有黑色、红色固体,滤液为无色,说明剩余固体中没有氧化铜,黑色固体一定是木炭,加入稀硫酸没有参加反应,故滤液中溶质为硫酸,试管中的剩余固体为木炭. b、若滤纸上有黑色、红色固体,而滤液呈蓝色,说明氧化铜与木炭都剩余,此时滤液中的溶质一定含有硫酸与氧化铜反应生成的硫酸铜,而硫酸是过量的,所以溶质还有硫酸. 故答案为:①C+2CuO
(3)因为方案一即使硫酸不过量,氢氧化钠和硫酸生成的硫酸钠也与氯化钡反应生成硫酸钡沉淀,而活泼金属锌能与酸反应生成氢气、石蕊试液遇酸变红色,所以方案二、三正确; 故答案为:①方案二和方案三;②溶液中有生成的硫酸钠,加入氯化钡溶液即使硫酸不过量同样产生白色沉淀. |
相似问题
纯净物X完全燃烧的化学方程式为X+3O2 点燃 . 2CO2+2H2O 则X的化学式是______
纯净物X完全燃烧的化学方程式为X+3O2点燃 2CO2+2H2O,则X的化学式是______,它属于______(填“有机物”或“无机物”).
在一密闭容器内有X Y Z Q四种物质 在一定条件下充分反应 测得反应前后各物质的质量如下:物质XY
在一密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:物质XYZQ反应前的质量(g)1718344反应后的质量(g)00820
生活中既能降低水的硬度 又能杀菌消毒“84消毒液”的主要成分是次氯酸钠(NaClO) 制备其的化学方
生活中既能降低水的硬度,又能杀菌消毒“84消毒液”的主要成分是次氯酸钠(NaClO),制备其的化学方程式可表示为:2NaOH+X=NaClO+NaCl+H20,则X中氯元素
一定质量的某种物质X在足量的氧气中燃烧 生成44g二氧化碳和36g水 则X的质量至少为多少( )A
一定质量的某种物质X在足量的氧气中燃烧,生成44g二氧化碳和36g水,则X的质量至少为多少( )A.16gB.32gC.48gD.12g
葡萄糖能为人体活动提供能量 其反应的化学方程式为C6H12O6 酶 . 6X+6H2O 则X的化学式
葡萄糖能为人体活动提供能量,其反应的化学方程式为C6H12O6酶 6X+6H2O,则X的化学式是( )A.CB.CO2C.COD.CH4












