计算AgCl在1.0mol.L—1NH2.H2O中的溶解度。 {KsΘ[Ag(NH3)2]+=1.1
计算AgCl在1.0mol.L—1NH2.H2O中的溶解度。 {KsΘ[Ag(NH3)2]+=1.12×107,KspΘ(Agcl)=1.80×10—10。假设Ag+与NH3结合产物都是[Ag(NH3)2]+)
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:设AgCl的溶解度为s。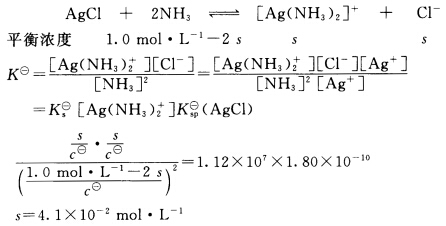
有酸效应、配位效应等副反应时,沉淀溶解度与溶度积之间的关系不能简单地套用公式,应具体问题具体分析。本题AgCl溶解并解离出来的Ag+有部分由于配位效应转化为[Ag(NH3)2+,使得AgCl的溶解度增大。解题时要紧紧抓住转化反应平衡常数决定的数量关系。
相似问题
下列关于化学平衡的叙述中 正确的是( )。A.升高温度平衡向放热反应方向移动B.温度的改变不能使化学
下列关于化学平衡的叙述中,正确的是( )。A.升高温度平衡向放热反应方向移动B.温度的改变不能使化学平衡发生移动C.改变浓度可引起平衡的移动,故平衡
分析下列反应自发进行的温度条件:2H2O2(1)→2H2O(1)+O2(g)△rHmΘ=—196kJ
分析下列反应自发进行的温度条件:2H2O2(1)→2H2O(1)+O2(g)△rHmΘ=—196kJ.mol—1请帮忙给出正确答案和分析,谢谢!
在任何AgCl溶液中 cr(Ag+)和cr(Cl—)的乘积都等于KspΘ(AgCl)。( )此题为判
在任何AgCl溶液中,cr(Ag+)和cr(Cl—)的乘积都等于KspΘ(AgCl)。( )此题为判断题(对,错)。请帮忙给出正确答案和分析,谢谢!
使用合适的催化剂能加快反应的速率 反应结束 催化剂本身组成不发生改变 质量也不变。说明催化剂并不参与
使用合适的催化剂能加快反应的速率,反应结束,催化剂本身组成不发生改变,质量也不变。说明催化剂并不参与反应,仅起促进反应进行的作用。( )此题为判
电池反应为2Fe2+(1mol.L—1)+I22Fe3+(0.0001mol.L—1)+2I—(0.
电池反应为2Fe2+(1mol.L—1)+I22Fe3+(0.0001mol.L—1)+2I—(0.0001mol.L—),原电池符号正确的是( )。A.(—)Fe|Fe2+(1mol.L—1),Fe3+(0.0001mo












