实验中用Br2水在碱性介质中氧化Co2+ 已知Eθ(Br2/Br-)=1.07 V Eθ(Co3+/
实验中用Br2水在碱性介质中氧化Co2+,已知Eθ(Br2/Br-)=1.07 V,Eθ(Co3+/Co2+)=1.84 V,KSPθ(Co(OH)3)=1.6×10-44,KSPθ(Co(OH)2)=1.6×10-15;计算: (1)Eθ(Co(OH)3/Co(OH)2); (2)反应的平衡常数Kθ。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:反应方程式为 2Co(OH)2+Br2+2OH-===2Co(OH)3+2Br-。 (1)Eθ(Co(OH)3/Co(OH)2)===0.13 V 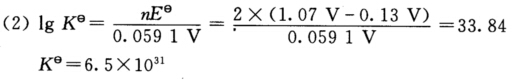
反应方程式为2Co(OH)2+Br2+2OH-===2Co(OH)3+2Br-。(1)Eθ(Co(OH)3/Co(OH)2)===0.13V
相似问题
如何判断氧化还原反应进行的完全程度?是否平衡常数大的氧化还原反应都能用于氧化还原滴定中?为什么?请帮
如何判断氧化还原反应进行的完全程度?是否平衡常数大的氧化还原反应都能用于氧化还原滴定中?为什么?请帮忙给出正确答案和分析,谢谢!
间接碘量法的主要误差来源为________________和________________。请帮忙
间接碘量法的主要误差来源为________________和________________。请帮忙给出正确答案和分析,谢谢!
根据Eθ(Fe2+/Fe)=一0.440 V Eθ(Sn4+/Sn2+)=0.1 54 V Eθ(S
根据Eθ(Fe2+/Fe)=一0.440 V,Eθ(Sn4+/Sn2+)=0.1 54 V,Eθ(Sn2+/Sn)=一0.136 V,Eθ(Cu2+/Cu+)=0.159 V,Eθ(Cu+/Cu)=0.522 V,判断在
已知在298.15 K时 下列半反应的电极电势: In3++3e-===In Eθ===.346 V
已知在298.15 K时,下列半反应的电极电势: In3++3e-===In Eθ===.346 V Zn2++2e-===Zn Eθ===0.760 V (1)判断反应3 Zn+2In3+===3 Zn2++2In
金属钠与水反应要比金属锂与水反应激烈 其主要原因是 ( )A.Eθ(Li+/Li)θ(Na+/Na)
金属钠与水反应要比金属锂与水反应激烈,其主要原因是 ( )A.Eθ(Li+/Li)θ(Na+/Na)B.金属锂表面有氧化物保护膜C.金属钠的熔点低于金属锂的熔点D.












