当把一些化合物按周期表中元素所在位置的关系列出它们的性质时 常常会发现它们的性质既有渐变的规律 也有
当把一些化合物按周期表中元素所在位置的关系列出它们的性质时,常常会发现它们的性质既有渐变的规律,也有突变的现象。现举例如下(数据引自:周公度,1993,结构与物性),请解释其原因。 (i)第三周期氟化物的熔点。  (ii)ⅣA族元素的性质。
(ii)ⅣA族元素的性质。 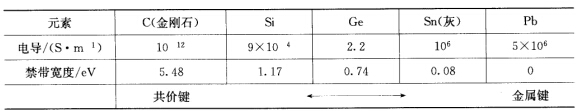 (iii)ⅥA族氢化物的沸点。
(iii)ⅥA族氢化物的沸点。  ⅥA族氢化物沸点示于图8—35。
ⅥA族氢化物沸点示于图8—35。 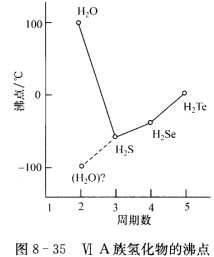
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:这是因为物质内部原子间的化学键类型不同而引起的。 在(i)中前三者熔点很高是因为两种元素的电负性差较大形成离子化合物靠离子键结合在一起即由金属离子Mn+与氟离子F-按静电作用力结合起来没有方向性和饱和性。以NaF为例正、负离子相互靠近接触吸引在一起周围配位的异号离子数尽可能多配位数为6:6形成一个无限的晶体结构熔点较高。NaF、MgF2、A1F3熔点依次升高是由于正离子价态增高离子键增强而SiF4则是共价型分子每个Si原子和4个F原子形成4个Si-F共价键每个F原子只和一个Si原子成键。SiF4分子间由微弱的范德华引力吸引在一起熔点较低。SiF4、PF5、SF6的晶体都是分子晶体随着相对分子质量依次增大范德华力增大所以熔点依次递增。 在(ii)中金刚石内部结构的每个C原子都和周围的4个C原子形成C一C共价键整块金刚石是由这种共价键形成的空间网状结构。又因最高满带和最低空带间的禁带较宽故为极好的绝缘体。Si、Ge、Sn也是A4结构禁带宽度依次减小Si与Ge是典型的半导体锡与铅电离能较小价电子容易脱离原子核的束缚形成金属键。锡与铅呈现金属性质较软、导电性好金属铅为立方最密堆积结构每个Pb原子周围有12个Pb原子配位。同一族元素C→Pb失电子能力逐渐增大原子问由典型的共价键过渡到典型的金属键所以导电性增高。 在(iii)中H2O、H2S、H2Se、H2Te是同一族元素的氢化物如果分子问作用力相似其性质应呈渐变规律。如图8—35所示按虚线外推水的沸点应为-1000℃与实际数据差值达200℃。这是由于O原子电负性大液态水中H2O分子间存在O一H…O氢键增加了分子间结合力。
这是因为物质内部原子间的化学键类型不同而引起的。在(i)中,前三者熔点很高,是因为两种元素的电负性差较大,形成离子化合物,靠离子键结合在一起,即由金属离子Mn+与氟离子F-按静电作用力结合起来,没有方向性和饱和性。以NaF为例,正、负离子相互靠近接触吸引在一起,周围配位的异号离子数尽可能多,配位数为6:6,形成一个无限的晶体结构,熔点较高。NaF、MgF2、A1F3熔点依次升高,是由于正离子价态增高,离子键增强,而SiF4则是共价型分子,每个Si原子和4个F原子形成4个Si-F共价键,每个F原子只和一个Si原子成键。SiF4分子间由微弱的范德华引力吸引在一起,熔点较低。SiF4、PF5、SF6的晶体都是分子晶体,随着相对分子质量依次增大,范德华力增大,所以熔点依次递增。在(ii)中,金刚石内部结构的每个C原子都和周围的4个C原子形成C一C共价键,整块金刚石是由这种共价键形成的空间网状结构。又因最高满带和最低空带间的禁带较宽,故为极好的绝缘体。Si、Ge、Sn也是A4结构,禁带宽度依次减小,Si与Ge是典型的半导体,锡与铅电离能较小,价电子容易脱离原子核的束缚形成金属键。锡与铅呈现金属性,质较软、导电性好,金属铅为立方最密堆积结构,每个Pb原子周围有12个Pb原子配位。同一族元素C→Pb失电子能力逐渐增大,原子问由典型的共价键过渡到典型的金属键,所以导电性增高。在(iii)中,H2O、H2S、H2Se、H2Te是同一族元素的氢化物,如果分子问作用力相似,其性质应呈渐变规律。如图8—35所示,按虚线外推,水的沸点应为-1000℃,与实际数据差值达200℃。这是由于O原子电负性大,液态水中H2O分子间存在O一H…O氢键,增加了分子间结合力。
相似问题
一个望远镜光学系统由两个薄正透镜组成 已知物镜的焦距f1=1000mm 其通光口径D1=50mm 物
一个望远镜光学系统由两个薄正透镜组成,已知物镜的焦距f1=1000mm,其通光口径D1=50mm,物镜与目镜相隔1200mm,目镜的通光口径D2=20mm,其光学间隔△=0。
根据宏观对称要素知道某晶体属Dzd点群 由此可判断此晶体属于( )晶系。A.四方B.立方C.正交D.
根据宏观对称要素知道某晶体属Dzd点群,由此可判断此晶体属于( )晶系。A.四方B.立方C.正交D.单斜请帮忙给出正确答案和分析,谢谢!
①醛基中质子 ②烯烃中质子 ③炔烃中质子的化学位移大小次序如何?为什么?请帮忙给出正确答案和分析 谢
①醛基中质子、②烯烃中质子、③炔烃中质子的化学位移大小次序如何?为什么?请帮忙给出正确答案和分析,谢谢!
大蒜素的结构为①还是②多年来一直有争议 已知大蒜素的X光电子能谱S2p有两组峰 间隔4.4eV。试推
大蒜素的结构为①还是②多年来一直有争议,已知大蒜素的X光电子能谱S2p有两组峰,间隔4.4eV。试推断上述结构式中哪一个为合理的结构式,并分析这两个S2p
下列每对离子中哪一个极化能力大 为什么? ①K+和Ag+; ②K+和Li+; ③Li+和Be2+;
下列每对离子中哪一个极化能力大,为什么? ①K+和Ag+; ②K+和Li+; ③Li+和Be2+; ④Ti2+和Ti4+; ⑤Cu2+和Ca2+。请帮忙给出正确答案和分析,谢谢!












