某离子晶体经X射线鉴定为立方晶系 其中顶点由Ti4+所占据 棱心和体心位置分别被O2-和Ba2+所占
某离子晶体经X射线鉴定为立方晶系,其中顶点由Ti4+所占据,棱心和体心位置分别被O2-和Ba2+所占据,讨论下列问题:①用分数坐标表示诸离子在晶胞中的位置;②写出晶体的化学组成;③指出晶体的点阵型式;④指出正离子Ba2+和Ti4+对于负离子O2-的配位数;⑤验证此晶体是否符合电价规则;⑥指出Ba2+和O2-联合组成了哪种形式的密堆积?
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:①Ti4+(000)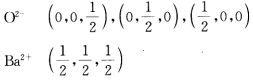 ②BaTiO3。 ③立方简单点阵。 ④Ba2+周围有12个O2-所以配位数为12;Ti4+周围有6个O2-配位数为6。 ⑤按鲍林第一规则Ba2+的静电强度为
②BaTiO3。 ③立方简单点阵。 ④Ba2+周围有12个O2-所以配位数为12;Ti4+周围有6个O2-配位数为6。 ⑤按鲍林第一规则Ba2+的静电强度为 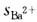 =正离子的电价数/正离子的配位数=ω+/n+=2/12=1/6
=正离子的电价数/正离子的配位数=ω+/n+=2/12=1/6 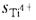 =4/6=2/3 每个O2-周同有4个Ba2+以及2个Ti4+相连按鲍林第二规则负离子的电价数为 ω=
=4/6=2/3 每个O2-周同有4个Ba2+以及2个Ti4+相连按鲍林第二规则负离子的电价数为 ω=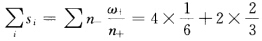 =2 与O2-电价数为-2是一致的所以符合电价规则。 ⑥体心和棱心的Ba2+、O2-共同构成了A1型堆积。BaTiO3的离子型结构属于钙钛矿型结构。
=2 与O2-电价数为-2是一致的所以符合电价规则。 ⑥体心和棱心的Ba2+、O2-共同构成了A1型堆积。BaTiO3的离子型结构属于钙钛矿型结构。
①Ti4+(0,0,0)②BaTiO3。③立方简单点阵。④Ba2+周围有12个O2-,所以配位数为12;Ti4+周围有6个O2-,配位数为6。⑤按鲍林第一规则,Ba2+的静电强度为=正离子的电价数/正离子的配位数=ω+/n+=2/12=1/6=4/6=2/3每个O2-周同有4个Ba2+以及2个Ti4+相连,按鲍林第二规则,负离子的电价数为ω==2与O2-电价数为-2是一致的,所以符合电价规则。⑥体心和棱心的Ba2+、O2-共同构成了A1型堆积。BaTiO3的离子型结构属于钙钛矿型结构。
相似问题
指出下列晶胞所属晶系: ①a=736pm b=534pm c=1245pm α≠β≠γ ②a=b=1
指出下列晶胞所属晶系: ①a=736pm,b=534pm,c=1245pm,α≠β≠γ ②a=b=1073pm,c=1430pm,α=β=90°,γ=120°请帮忙给出正确答案和分析,谢谢!
在正八面体配合物中 中心离子的d1~d10的排布 在弱场(电子成对能P>分裂能△o)时与强场(分裂能
在正八面体配合物中,中心离子的d1~d10的排布,在弱场(电子成对能P>分裂能△o)时与强场(分裂能△o>电子成对能P)时有什么不同?请帮忙给出正确答案和分
证明面心点阵的消光条件是h k Z奇偶混杂。请帮忙给出正确答案和分析 谢谢!
证明面心点阵的消光条件是h、k、Z奇偶混杂。请帮忙给出正确答案和分析,谢谢!
已知金属Ni为A1型结构 原子间最近接触距离为249.2pm 试计算立方晶胞的边长以及金属Ni的密度
已知金属Ni为A1型结构,原子间最近接触距离为249.2pm,试计算立方晶胞的边长以及金属Ni的密度。请帮忙给出正确答案和分析,谢谢!
气体HCl的转动光谱在远红外区如下波数位置出现吸收峰:8382m-1 10413m-1 12473m
气体HCl的转动光谱在远红外区如下波数位置出现吸收峰:8382m-1、10413m-1、12473m-1、…、22680m-1。8382m-1,10413m-1的吸收带分别是由哪两个转动能级间












