试解释为什么从HClO4 HClO3到HClO2酸性依次减弱。 (2)试写出ClO4- ClO3-
试解释为什么从HClO4,HClO3到HClO2酸性依次减弱。 (2)试写出ClO4-,ClO3-,ClO2-碱性的相对强度。 (3)请根据(1)的结论解释为什么H3PO4,H3PO3和H3PO2的酸强度差别很小。
请帮忙给出正确答案和分析,谢谢!
参考解答
正确答案:解:(1)3种物质的结构如下。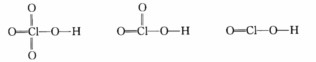 由于氧的电负性比氯强非羟基氧都倾向于从氯夺得电子使氯对羟基氧的吸引力增强从而削弱O—H键增大质子解离趋势。含氧酸中非羟基氧的个数越多O—H键被削弱的程度越大质子的解离趋势也就越大。HClO4HClO3HClO2中非羟基氧的个数依次减少因此酸性依次减弱。 (2)共轭酸越强其共轭碱越弱。由于HClO2HClO3HClO4的酸性依次增强因此相应共轭碱C1O-ClO3-ClO4-的碱性依次减弱。(3)H3PO4H3PO3和H3PO2的结构如下:
由于氧的电负性比氯强非羟基氧都倾向于从氯夺得电子使氯对羟基氧的吸引力增强从而削弱O—H键增大质子解离趋势。含氧酸中非羟基氧的个数越多O—H键被削弱的程度越大质子的解离趋势也就越大。HClO4HClO3HClO2中非羟基氧的个数依次减少因此酸性依次减弱。 (2)共轭酸越强其共轭碱越弱。由于HClO2HClO3HClO4的酸性依次增强因此相应共轭碱C1O-ClO3-ClO4-的碱性依次减弱。(3)H3PO4H3PO3和H3PO2的结构如下: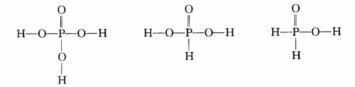 3个分子的酸性来自于O—H键的电离。P和H的电负性相差不多P—H键既没有电离趋势也不会影响O—H键的电离。由于3个分子都含有相同的非羟基氧原子数目根据(1)可知O—H键的电离程度应该没有显著区别即酸性非常接近。
3个分子的酸性来自于O—H键的电离。P和H的电负性相差不多P—H键既没有电离趋势也不会影响O—H键的电离。由于3个分子都含有相同的非羟基氧原子数目根据(1)可知O—H键的电离程度应该没有显著区别即酸性非常接近。
解:(1)3种物质的结构如下。由于氧的电负性比氯强,非羟基氧都倾向于从氯夺得电子,使氯对羟基氧的吸引力增强,从而削弱O—H键,增大质子解离趋势。含氧酸中非羟基氧的个数越多,O—H键被削弱的程度越大,质子的解离趋势也就越大。HClO4,HClO3,HClO2中非羟基氧的个数依次减少,因此酸性依次减弱。(2)共轭酸越强,其共轭碱越弱。由于HClO2,HClO3,HClO4的酸性依次增强,因此相应共轭碱C1O-,ClO3-,ClO4-的碱性依次减弱。(3)H3PO4,H3PO3和H3PO2的结构如下:3个分子的酸性来自于O—H键的电离。P和H的电负性相差不多,P—H键既没有电离趋势也不会影响O—H键的电离。由于3个分子都含有相同的非羟基氧原子数目,根据(1)可知O—H键的电离程度应该没有显著区别,即酸性非常接近。
相似问题
当样本量增大时 样本比例的标准差有何变化?请帮忙给出正确答案和分析 谢谢!
当样本量增大时,样本比例的标准差有何变化?请帮忙给出正确答案和分析,谢谢!
有一个班40名学生的统计学考试成绩如表3-3所示。 学校规定:60分以下为不及格;60~75分为中
有一个班40名学生的统计学考试成绩如表3-3所示。 学校规定:60分以下为不及格;60~75分为中;76~89分为良;90~100分为优。试把该班学生分为不及格
样本方差S2的抽样分布是什么?请帮忙给出正确答案和分析 谢谢!
样本方差S2的抽样分布是什么?请帮忙给出正确答案和分析,谢谢!
某厂3种产品的产量情况如表10-6所示。 试分析出厂价格和产量的变动对总产值的影响。请帮忙给出正确
某厂3种产品的产量情况如表10-6所示。 试分析出厂价格和产量的变动对总产值的影响。请帮忙给出正确答案和分析,谢谢!
绘制直方图 折线图以及向上 向下累积图。此题为多项选择题。请帮忙给出正确答案和分析 谢谢!
绘制直方图、折线图以及向上、向下累积图。此题为多项选择题。请帮忙给出正确答案和分析,谢谢!












