X Y Z三种固体物质溶解度曲线如图所示.请回答:(1)若保持溶质和溶剂的量不变 欲将不饱和的 Z溶
| X、Y、Z三种固体物质溶解度曲线如图所示.请回答: (1)若保持溶质和溶剂的量不变,欲将不饱和的 Z溶液转化为 饱和溶液,可采用的方法是______. (2)60℃时,把 45g的 X 加入 50g水中,充分溶解,得到该温度下X的溶液是______(填“饱和”或“不饱和”)溶液. (3)从含有少量 X的 Y的溶液中提取 Y,最好应采用的方法是______(填“冷却结晶”或“蒸发结晶”). (4)现有 40℃时 X、Y、Z 三种饱和溶液,分别将它们升高温度到 60℃时三种溶液的溶质质量 分数的大小关系为______. 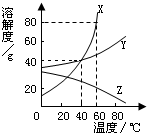 |
参考解答
| (1)由Z的溶解度曲线可知,Z的溶解度随温度的升高溶解度减小,所以可以采用升温的方法是不饱和溶液变为饱和. 故答案为:升高温度 (2)由于在60℃时,X的溶解度是80g,即在100克水中最多溶解80g,因此将45gX物质溶于50g水中所形成的溶液是饱和溶液, 故答案为:饱和 (3)根据X、Y物质的溶解度曲线不难看出,X物质溶解度随温度升高溶解度快速增大,而Y物质的溶解度随温度的变化不大,所以可以采用蒸发结晶的方法将Y提取. 故答案为:蒸发结晶 (4)40℃时 X、Y、Z 三种饱和溶液的溶解度关系为X=Y>Z,溶质的质量分数也是这样的关系,分别将它们升高温度到 60℃时,XY溶解度增大,溶液变为不饱和溶液,所以XY的溶液的质量分数不变,仍然相等,而Z物质的溶解度减小,有晶体析出,溶质的质量分数继续减小,所以三种溶液的溶质质量分数的大小关系为X=Y>Z 故答案为:X=Y>Z |
相似问题
60℃时 化合物甲的溶解度比乙大.分别取等质量60℃时的甲 乙的饱和溶液 降温至20℃后 析出甲和乙
60℃时,化合物甲的溶解度比乙大.分别取等质量60℃时的甲、乙的饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水).以下叙述
根据物质的溶解度和溶解过程的有关知识回答下列问题。 (1) 20C时 34g KCl溶解在10
根据物质的溶解度和溶解过程的有关知识回答下列问题。(1) 20C时,34g KCl溶解在100g水中恰好达到饱和,则该温度下,KCl的溶解度为___g。(2)相同条件下
下列说法正确的是 [ ]A 把10克氯化钠溶解在100克水里恰好制成饱和溶液 氯化钠的溶
下列说法正确的是 [ ]A、把10克氯化钠溶解在100克水里恰好制成饱和溶液,氯化钠的溶解度就是10克 B、20℃时,10克氯化钠溶解在水里制成饱和溶液,故20
水是生命之源 通过化学学习 我们进一步认识了水的作用。(1)水和蛋白质 油脂 维生素以及______
水是生命之源,通过化学学习,我们进一步认识了水的作用。(1)水和蛋白质、油脂、维生素以及_________是人体所需的六大类营养素。(2)水是重要的工业原
t℃时将NaOH溶液蒸去8.2g水后 恢复至t℃时 析出5.8gNaOHH2O晶体 再蒸去1.2g水
t℃时将NaOH溶液蒸去8 2g水后,恢复至t℃时,析出5 8gNaOHH2O晶体,再蒸去1 2g水,恢复至t℃时,又析出5 8gNaOHH2O晶体,则t℃时无水NaOH的溶解度约为[












