锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2?6H2O)具有很高的经济价值 61℃
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2?6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图: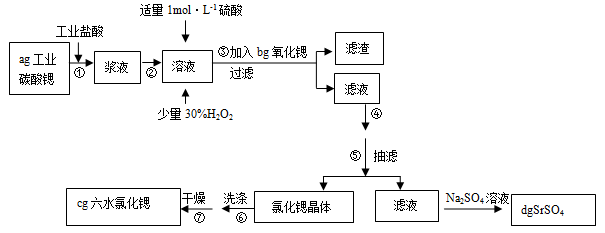 请回答: (1)加入少量30%H2O2的作用 (用离子方程式表示); (2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ; (3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
 (5)计算原工业碳酸锶粉末中碳酸锶的质量分数 (列计算式即可)。 |
参考解答
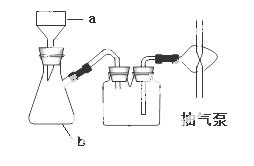
(1)H2O2+2Fe2++2H+=2Fe3++2H2O ; (2)调节pH,使Fe3+转化为氢氧化铁沉淀而除去,温度高有利于除去湿存水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去; (3)蒸发浓缩 冷却结晶 D (4)吸滤瓶 用蒸馏水润湿滤纸,微开水龙头; (5) 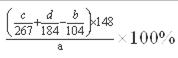 |
试题分析:碳酸锶与盐酸反应生成氯化锶、水、二氧化碳.碳酸锶不溶于水,氯化锶易溶于水,反应离子方程式为:SrCO3+2H+=Sr2++H2O+CO2↑。溶液中大部分是氯化锶,所以加入硫酸后会先生成硫酸锶, 由于硫酸钡的溶解度小于硫酸锶,所以会进一步转化为硫酸钡沉淀。双氧水具有强氧化性,在酸性条件下,双氧水将Fe2+氧化为Fe3+,自身被还原为H2O。(1) 加入少量30%H2O2的作用,将亚铁离子氧化成三价铁离子;(2) 步骤③中氧化锶粉末的作用是调节pH,使Fe3+转化为氢氧化铁沉淀而除去;工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是温度高有利于除去湿存水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去;(3)步骤④进行的实验操作为蒸发浓缩、冷却结晶 ,步骤⑥中,洗涤氯化锶晶体最好选用氯化锶饱和溶液;(4) 仪器b 的名称吸滤瓶, 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上;(5)根据锶元素守恒,原工业碳酸锶粉末中碳酸锶的质量分数 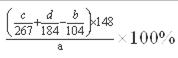 。 。 |
相似问题
下列仪器中 常用于物质分离的是( )。A.①③ B.②③ C.②④ D.①②
下列仪器中,常用于物质分离的是( )。A.①③ B.②③ C.②④ D.①②
下列实验现象和结论相符的是 操作及现象结论A溶液中加入盐酸 产生使澄清石灰水变浑浊的无色无味气体溶液
下列实验现象和结论相符的是操作及现象结论A溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体溶液中一定含有CO32-B某溶液中加入硝酸银,产生白色沉
三苯甲醇是一种重要有机合成中间体 可以通过下列原理进行合成: 实验步骤如下: ①如图1所示 在三颈烧
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成: 实验步骤如下: ①如图1所示,在三颈烧瓶中加入A,1 5 g镁屑,在滴液漏斗中加入,6 7
下列实验设计能够成功的是 实验目的实验步骤及现象A检验亚硫酸钠试样是否变质B检验某卤代烃是否是氯代烃
下列实验设计能够成功的是实验目的实验步骤及现象A检验亚硫酸钠试样是否变质B检验某卤代烃是否是氯代烃C证明酸性条件H2O2氧化性比I2强D除去铁屑表面的油
海洋资源的利用具有广阔前景。(1)无需经过化学变化就能从海水中获得的物质是________(填序号)
海洋资源的利用具有广阔前景。(1)无需经过化学变化就能从海水中获得的物质是________(填序号)A.Cl2B.淡水C.烧碱D.食盐(2)从海水中提取溴的主要












