(10分)海藻中含有丰富的碘元素 碘元素通常以的形式存在。实验室从海藻灼烧后的海藻灰中提取的流程如图
(10分)海藻中含有丰富的碘元素,碘元素通常以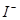 的形式存在。实验室从海藻灼烧后的海藻灰中提取 的形式存在。实验室从海藻灼烧后的海藻灰中提取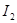 的流程如图所示: 的流程如图所示: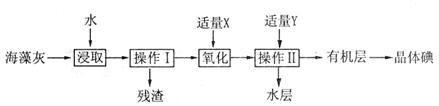 (1)操作I是__________,操作II是__________。 (2)试剂X可以选择__________。 A. 氯气 B. 氢氧化钠 C. 过氧化氢 D. 稀硫酸 (3)试剂Y可以选择__________。 A. 酒精 B. 四氯化碳 C. 醋酸 D. 苯 (4)该实验中为使海藻灰中I-转化为I2的有机溶液,除烧杯、普通漏斗和必要的夹持仪器外,还需要的玻璃仪器有__________、__________。 (5)操作II完成后,判断水层中是否残留I2的实验方法是__________。 |
参考解答
| (1)过滤(1分)萃取(萃取和分液)(1分) (2)A、C(2分) (3)B、D(2分) (4)玻璃棒(1分)分液漏斗(1分) (5)取少量水层样品于试管中,加入少量淀粉溶液,若变蓝则残留I2,若不变蓝,则不残留I2。(2分) |
| (1)灼烧后的海藻灰中含有不溶性物质,通过过滤即可除去,即操作I是过滤。X能把溶液中的碘离子氧化生成单质碘,而碘易溶在有机溶剂中,所以操作Ⅱ是萃取。 (2)氯气和过氧化氢都具有氧化性,能氧化碘离子,生成单质碘,而氢氧化钠和稀硫酸不能氧化碘离子,所以答案选AC。 (3)作为萃取剂的Y应该满足和水不溶,且碘易溶在Y中,酒精和乙酸与水是互溶的,不能作为萃取剂,答案选BD。 (4)根据实验原理可知,溶解时需要玻璃棒,萃取时需要分液漏斗。 (5)由于碘能和淀粉发生显色反应,据此可以鉴别碘的存在。即取少量水层样品于试管中,加入少量淀粉溶液,若变蓝则残留I2,若不变蓝,则不残留I2。 |
相似问题
(6分)下列A B C D是中学常见的混合物分离或提纯的基本装置。请根据混合物分离或提纯的原理 回答
(6分)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适
为了除去FeCl2溶液中混有的少量FeCl3 最好的方法是向此溶液中( )。A.通入氯气B.
为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中( )。A.通入氯气B.加入ZnC.加入FeD.加入Cu
白酒 食醋 蔗糖 淀粉等均为家庭厨房中常用的物质 利用这些物质能完成下列实验的是A.鉴别食盐和小苏打
白酒,食醋,蔗糖,淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是A.鉴别食盐和小苏打B.检验自来水中是否含氯离子C.检验雨水的酸碱度D
下列分离或提纯物质的方法错误的是A.用渗析的方法精制氢氧化铁胶体B.用加热的方法提纯含有少量碳酸氢钠
下列分离或提纯物质的方法错误的是A.用渗析的方法精制氢氧化铁胶体B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠C.用溶解、过滤的方法提纯含有少量硫酸
下列物质的分离方法不正确的是( )A.用结晶的方法分离汽油和水;B.用过滤的方法除去氯化钠溶液
下列物质的分离方法不正确的是()A.用结晶的方法分离汽油和水;B.用过滤的方法除去氯化钠溶液中的泥沙;C.用重结晶的方法从含有少量氯化钠的硝酸钾溶












