张明同学在学习“硫酸及其盐的某些性质与用途”中 进行如下实验探究。[实验一]探究浓硫酸的氧化性。将实
| 张明同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究。 [实验一]探究浓硫酸的氧化性。 将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略) |
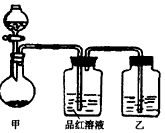 |
| (1)该装置在设计上存在明显的缺陷,请指出:_____________________。 (2)写出装置甲中反应的化学方程式:______________________。 (3)装置乙中的试剂是_____________。 [实验二]探究某硫酸亚铁盐固体是否变质。 (4)请你帮助张明同学完成如下实验方案: |
 |
| [实验三]用KHSO4制取H2O2并测其质量分数。查阅资料得知,工业上电解KHSO4饱和溶液制取H2O2的示意图如下: |
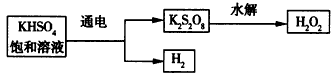 |
| 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑) ①取5. 00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中,加水稀释,再加稀硫酸酸化; ②用0. 100 0 mol/L KMnO4溶液滴定; ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19. 98 mL、20.02 mL。 回答下列问题: (5)电解饱和KHSO4溶液时,阳极的电极反应式为__________________。 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消 失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是________________。 (7)原H2O2溶液中溶质的质量分数为_________。 |
参考解答
| (1)装置乙不应有瓶塞 (2)Cu+2H2SO4(浓) 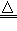 CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O(3)氢氧化钠溶液 (4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;若溶液变为红色,说明该固体已变质,若溶液未变红色,说明该固体没有变质 (5)2SO42--2e-=S2O82- (6)作催化剂(或加快反应速率) (7)3.4%(或0. 034) |
相似问题
用实验确定某酸HA是弱电解质。两同学的方案是:甲:①称取一定质量的HA配制0.1mol/L的溶液10
用实验确定某酸HA是弱电解质。两同学的方案是:甲:①称取一定质量的HA配制0 1mol L的溶液100mL ②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质乙:
将试管放人盛有25℃饱和石灰水的烧杯中 试管中开始放入小块镁片 再用滴管滴人5 mL盐酸于试管中 试
将试管放人盛有25℃饱和石灰水的烧杯中,试管中开始放入小块镁片,再用滴管滴人5 mL盐酸于试管中,试回答下列问题:(1)实验中观察到的现象是_________
将绿矾(FeSO4·7H2O) 硫酸铵[(NH4)2SO4]以相等物质的量混合可制得摩尔盐[FeSO
将绿矾(FeSO4·7H2O)、硫酸铵[(NH4)2SO4]以相等物质的量混合可制得摩尔盐[FeSO4·(NH4)2SO4·6H2O]晶体。 I.根据上图回答:(1)步骤1的主要作用是______
某课外小组同学对不同条件下铁钉的锈蚀进行了实验 并于一周后观察。(1)铁钉被腐蚀程度最大的是____
某课外小组同学对不同条件下铁钉的锈蚀进行了实验,并于一周后观察。(1)铁钉被腐蚀程度最大的是____(填实验序号)。 (2)实验③中主要发生的是____(填
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为两者反应生成只
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为两者反应生成只有CuCO3一种沉淀;乙同学认为这两者相互促进水解,生成Cu(












