节日期间因燃放鞭炮会引起空气中SO2含量增高 造成大气污染。某实验小组同学欲探究SO2的性质 并测定
| 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。 (1)他们设计如下实验装置,请你参与探究,并回答问题: 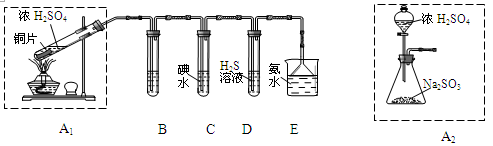 ①装置A1中发生反应的化学方程式为 ; ②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质; ③装置C中反应的离子方程式为 ; ④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ; (2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。 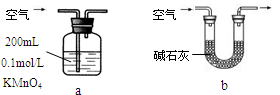 ①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ; ②你认为哪个装置不可行(填序号) ,说明理由 。 |
参考解答
(1)① Cu + 2H2SO4(浓)  CuSO4 + 2H2O + SO2↑;②品红溶液;氧化;③SO2 + I2 + 2H2O =SO42- + 2I-+ 4H+ ; ④不用加热(或:节约能源,节约药品);相对安全;易于控制反应进行;反应更充分; (2)① a ;当KMnO4溶液刚褪色时,测定通入空气的体积V; ② b ;空气中含有的CO2也能与碱石灰反应,造成测量不准确。 CuSO4 + 2H2O + SO2↑;②品红溶液;氧化;③SO2 + I2 + 2H2O =SO42- + 2I-+ 4H+ ; ④不用加热(或:节约能源,节约药品);相对安全;易于控制反应进行;反应更充分; (2)① a ;当KMnO4溶液刚褪色时,测定通入空气的体积V; ② b ;空气中含有的CO2也能与碱石灰反应,造成测量不准确。 |
试题分析:(1)①在装置A1中Cu与浓硫酸共热发生反应:Cu + 2H2SO4(浓)  CuSO4 + 2H2O + SO2↑;②装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性。在装置B用品红溶液检验。在装置D中发生反应:SO2+2H2S=3S↓+H2O。SO2是氧化剂,表现氧化性,H2S是还原剂,表现还原性。③在装置C中SO2与碘水发生I2+SO2+2H2O=H2SO4+2HI。反应的离子方程式为:I2+SO2+2H2O= SO42-+4H++2I-。④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,使用装置A2的优点是不用加热,可以节约能源,相对安全;易于控制反应进行;反应更充分等;(2)① 将含有SO2的空气通入到KMnO4溶液中,只有SO2能发生反应,所以可以测定空气中SO2含量。若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。对于b,由于空气中含有的CO2也能与碱石灰反应,水蒸气也能被吸收,因此会造成测量不准确。不能用于测定空气中SO2含量。2的制取、检验、性质、测定及化学方程式、离子方程式的书写的知识。 CuSO4 + 2H2O + SO2↑;②装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性。在装置B用品红溶液检验。在装置D中发生反应:SO2+2H2S=3S↓+H2O。SO2是氧化剂,表现氧化性,H2S是还原剂,表现还原性。③在装置C中SO2与碘水发生I2+SO2+2H2O=H2SO4+2HI。反应的离子方程式为:I2+SO2+2H2O= SO42-+4H++2I-。④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,使用装置A2的优点是不用加热,可以节约能源,相对安全;易于控制反应进行;反应更充分等;(2)① 将含有SO2的空气通入到KMnO4溶液中,只有SO2能发生反应,所以可以测定空气中SO2含量。若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。对于b,由于空气中含有的CO2也能与碱石灰反应,水蒸气也能被吸收,因此会造成测量不准确。不能用于测定空气中SO2含量。2的制取、检验、性质、测定及化学方程式、离子方程式的书写的知识。 |
相似问题
下列实验现象 与新制氯水中的某些成分(括号内物质)没有关系的是[ ]A. 将固体加入新制的氯
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是[ ]A. 将固体加入新制的氯水中,有无色气泡() B. 向溶液中滴加新制氯水,再滴
下列陈述Ⅰ Ⅱ正确并且有因果关系的是选项陈述Ⅰ陈述ⅡAH2O2 SO2都能使酸性高锰酸钾褪色前者表现
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是选项陈述Ⅰ陈述ⅡAH2O2、SO2都能使酸性高锰酸钾褪色前者表现出还原性后者表现出漂白性B纯银器表面在空气中渐渐变暗
铁在氯气中点燃 可观察到___ 发生反应的方程式为___;将产物溶于水后 向溶液中加入足量的铁粉 发
铁在氯气中点燃,可观察到___,发生反应的方程式为___;将产物溶于水后,向溶液中加入足量的铁粉,发生的反应是_______(写离子方程式),观察到的现象为
向某晶体的水溶液中加入Fe2+的溶液后 无明显变化 当滴加几滴氯水后 混合液出现红色。那么 由此得出
向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后,混合液出现红色。那么,由此得出下列的结论错误的是 [ ]A.该晶体中一定含有SCN-
当不慎有大量Cl2扩散到周围空间时 处在该环境中的人可以用浸有一定浓度某种物质水溶液的毛巾捂住鼻子以
当不慎有大量Cl2扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某种物质水溶液的毛巾捂住鼻子以防中毒,该物质最适宜采用的是[ ]A.NaOHB.NaCl












