将一定量的氯气通入250 mL溴化钾溶液中 然后将所得的溶液蒸干 并将残渣灼烧 得到干燥的残渣40
| 将一定量的氯气通入250 mL溴化钾溶液中,然后将所得的溶液蒸干,并将残渣灼烧,得到干燥的残渣40 g,分析残渣,其中含25%的化合态的溴,试计算: (1)通入的一定量的氯气是多少克?(氯气无剩余) (2)原溴化钾溶液含KBr多少克? |
参考解答
| (1)11.97 g (2)55.01 g |
| 溴化钾溶液中通入氯气,必然会产生氯化钾和溴,由已知25%的化合态的溴可设法求出溴化钾的质量,从而求出40 g残渣中氯化钾的质量,再根据化学反应方程式将氯化钾当成已知量以求算通入的氯气是多少克,并求原溶液中的溴化钾为多少克。搞清残渣成分和正确换算是关键。 40 g残渣中所含Br-的质量为:40 g×25%='10' g。求KBr的质量:由Br—KBr的质量比:80∶119得KBr的质量=10×119÷80='14.87' g。设x g Cl2与y g KBr反应生成了25.13 g KCl,则 Cl2+2KBr====2KCl+Br2 71 238 149 x y 25.13 x= 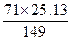 ='11.97' g ='11.97' gy= 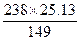 ='40.14' g ='40.14' g在250 mL溴化钾溶液中共含KBr的质量: 40.14 g+14.87 g='55.01' g。 |
相似问题
已知BrCl能发生如下发应:与金属:n BrCl+2M = MCln+MBrn 与水:BrCl+H
已知BrCl能发生如下发应:与金属:n BrCl+2M= MCln+MBrn与水:BrCl+H2O= HBrO+HCl下列判断不正确的是A.BrCl是共价化合物B.与水反应时,BrCl既是氧
A C E是中学化学中常见的单质 A是固体 C E是无色无味的气体 D是黑色晶体 它们之间的转化关系
A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。(1)写出A、B、C的化学式:A___________
下列试剂保存方法不正确的是( )A.AgNO3溶液保存在棕色细口瓶中B.氢氟酸保存在特制塑料瓶
下列试剂保存方法不正确的是( )A.AgNO3溶液保存在棕色细口瓶中B.氢氟酸保存在特制塑料瓶中C.澄清石灰水保存在带胶塞的无色细口玻璃瓶中D.AgBr保存在
用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热) 在不考虑HCl挥发的情况下 得
用1 mol MnO2和含HCl为4 mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量A.等于2 molB.等于1 molC.小于1 molD.大于2 mol
标准状况下有22.4L氯气和氢气的混合气体 在一密闭容器中使其充分反应 冷却后将此气体与1L1mol
标准状况下有22 4L氯气和氢气的混合气体,在一密闭容器中使其充分反应,冷却后将此气体与1L1mol·L-1的NaOH溶液充分反应,最后此溶液( )A.一定显












