(10分)把铁 氧化铁 氧化铜的混合物粉末放入110 mL 4 mol·L-1盐酸中 充分反应后产生
| (10分)把铁、氧化铁、氧化铜的混合物粉末放入110 mL 4 mol·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.4 mol·L-1。试求原混合物的总质量。 |
参考解答
| 13.6 g |
因滤液显酸性(即盐酸过剩),所以,残留固体只可能是铜,据题意可得反应物和生成物变化的关系: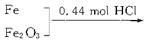 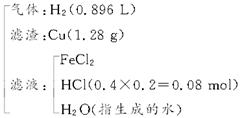 由Cu元素守恒可得: n(CuO)='n(Cu)=1.28' g/64 mol·L-1='0.02' mol 由氯元素守恒可得: 2n(FeCl2)+n(HCl)余=n(HCl)总='0.44' mol 即2n(FeCl2)+0.08 mol='0.44' mol,则n(FeCl2)='0.18' mol。 又由氢元素守恒可得: 2n(H2O)生成+2n(H2)+n(HCl)余=n(HCl)总='0.44' mol,解得反应产物中水的物质的量为n(H2O)生成='0.14' mol。 由氧元素守恒可得: 3n(Fe2O3)+n(CuO)=n(H2O)生成, 解得:n(Fe2O3)='0.04' mol 最后由铁元素守恒可得: n(Fe)+2n(Fe2O3)=n(FeCl2) 解得:n(Fe)='0.1' mol 综上可知,原混合物总质量为: m(总)='56' g·mol-1×0.1 mol+160 g·mol-1×0.04 mol+80 g·mol-1×0.02 mol='13.6' g |
相似问题
如图所示:若关闭Ⅰ阀 打开Ⅱ阀 让潮湿的氯气经过甲瓶后 通入乙瓶 布条不褪色;若关闭Ⅱ阀打开Ⅰ阀 再
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气 氯化锰等 下图是制取并探究Cl2化学性质的装置图。(
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。(1)写出圆底烧瓶中反应的化学方程式。(2)A中m管的作
海水中含量最多的离子是( )A.钠离子B.氯离子C.钙离子D.镁离子
海水中含量最多的离子是( )A.钠离子B.氯离子C.钙离子D.镁离子
用含4 mol HCl的浓盐酸与足量的MnO2共热 生成的氯气为( )A.2 molB.1 mo
用含4 mol HCl的浓盐酸与足量的MnO2共热,生成的氯气为()A.2 molB.1 molC.小于1 molD.小于2 mol,大于1 mol
下列叙述中正确的是( )A.碘易升华 所以要保存在铁盖旋紧的试剂瓶中B.液溴应保存在磨口玻璃塞棕
下列叙述中正确的是()A.碘易升华,所以要保存在铁盖旋紧的试剂瓶中B.液溴应保存在磨口玻璃塞棕色试剂瓶中,并加少量水进行水封C.能使淀粉碘化钾试纸












