某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现 在足量的稀氯化亚铁溶液中 加入1~2
| 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。 (1)提出问题:Fe3+、Br2谁的氧化性更强? (2)提出猜想: ①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。 ②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。 (3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。 供选用的试剂: a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液 请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
(4)应用与拓展: ①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。 ②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有 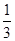 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。 |
参考解答
| (2)①Br2 ②Fe3+ (3)d 溶液呈血红色 b CCl4层呈无色 (4)①2Fe2++Br2=2Fe3++2Br- ②1.2 mol·L-1 |
(2)①若氧化性Fe3+>Br2,则Br2不能氧化Fe2+,故溶液呈黄色是加入的Br2的颜色。②若氧化性Br2>Fe3+,则Br2能将Fe2+氧化成Fe3+,故溶液呈黄色是因为生成的Fe3+显黄色。(4)②氧化性Br2>Fe3+,则还原性Fe2+>Br-,Cl2通入FeBr2溶液中先与Fe2+反应,若Cl2还有剩余再与Br-发生反应。现有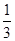 的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+ 的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+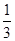 n(Br-)=0.20 mol,又因为n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。 n(Br-)=0.20 mol,又因为n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。 |
相似问题
Na2O2 CaC2都能与水反应 且反应中都有气体放出。下列说法正确的是A.都属于氧化还原反应B.生
Na2O2、CaC2都能与水反应,且反应中都有气体放出。下列说法正确的是A.都属于氧化还原反应B.生成的气体均为氧化产物C.反应物水均作氧化剂D.反应均放热
从矿物学资料查得 一定 条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O====7
从矿物学资料查得,一定 条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4 下列说法正确的是[ ]A.Cu2S既是氧化产物又是还原
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在催化剂作用下可发生氧化还原反应 生成高
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在催化剂作用下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸(1)完成反应的化学方程式,并表示
在反应KClO3+6HCl(浓)==3Cl2↑+KCl+3H2O中 被还原的氯原子和被氧化的氯原子的
在反应KClO3+6HCl(浓)==3Cl2↑+KCl+3H2O中,被还原的氯原子和被氧化的氯原子的个数之比为[ ]A.1:6 B.5:l C.1:5 D.6:1
下列微粒中 只有氧化性的是[ ]A.FeB.Fe2+C.Fe3O4D.Fe3+
下列微粒中,只有氧化性的是[ ]A.FeB.Fe2+C.Fe3O4D.Fe3+












