(12分)氧化还原反应在生产 生活中具有广泛的用途 贯穿古今。(1)下列生产 生活中的事例中发生了氧
| (12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。 (1)下列生产、生活中的事例中发生了氧化还原反应的是 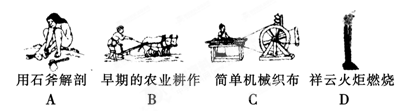 (2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。 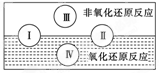 试写出有水参加的符合反应类型Ⅳ的一个化学方程式: 其中水为________剂。 (3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。 ①该过程反应的化学方程式为__________________________。 ②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平: ________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。 (4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。 |
参考解答
(1)D (2)C+H2O(g) CO+H2(2分) 氧化(合理即可) CO+H2(2分) 氧化(合理即可)(3)①4FeS2+15O2+2H2O  2Fe2(SO4)3+2H2SO4(2分) 2Fe2(SO4)3+2H2SO4(2分)②1 10 4 2 10 8 H+(2分) (4)N2O(2分) |
| (1)ABC都是物理变化,燃烧是氧化还原反应,答案选D。 (2)Ⅳ是置换反应,所以方程式可以是C+H2O(g)  CO+H2,在该反应中水是氧化剂。 CO+H2,在该反应中水是氧化剂。(3)①溶液酸性增强,说明反应中还生成硫酸,所以方程式为4FeS2+15O2+2H2O  2Fe2(SO4)3+2H2SO4。 2Fe2(SO4)3+2H2SO4。②根据原子守恒可知,另一种生成物是氢离子。1molCu2S失去10mol电子,所以需要氧化剂Fe3+是10mol,然后观察法配体其它的。 (4)设羟胺的氧化产物中氮元素的化合价是n,则根据电子的得失守恒可知,25×0.049×(n+1)=24.5×0.020×(7-2),解得n=1,所以氧化产物是N2O。 |
相似问题
下列反应中属于氧化还原反应 且水作为氧化剂的是A.Cl2 + H2O =' HCl' + HClOB
下列反应中属于氧化还原反应,且水作为氧化剂的是A.Cl2 + H2O = " HCl " + HClOB.2F2 + 2H2O = " 4HF " + O2C.2Na + 2H2O = " 2NaOH " + H2↑D.2Na2O2 + 2H2O = " 4NaOH " + O2↑
实验室中 通常以草酸钠(Na2C2O4)为标准液 通过氧化还原滴定来测定高锰酸钾溶液的浓度 其反应的
实验室中,通常以草酸钠(Na2C2O4)为标准液,通过氧化还原滴定来测定高锰酸钾溶液的浓度,其反应的化程程为:C2O42—+MnO4—+H+—Mn2++CO2↑+H2O(未配
溴的氧化性介于氯和碘之间。利用这一性质判断 下列说法正确的是( )A.Cl— I—离子加入到含
溴的氧化性介于氯和碘之间。利用这一性质判断,下列说法正确的是()A.Cl—、I—离子加入到含Br—的溶液中,均可以将Br—氧化为Br2B.将Cl2缓慢通入含
下列反应属于氧化还原反应 且△H>0的是A.Ba(OH)2·8H2O与NH4Cl反应B.灼热的炭与C
下列反应属于氧化还原反应,且△H>0的是A.Ba(OH)2·8H2O与NH4Cl反应B.灼热的炭与CO2反应C.铝片与稀H2SO4反应D.甲烷在O2中的燃烧反应
下列反应中 不是氧化还原反应的是 ( )①H2+Cl22HCl ②Na2CO3+2HCl==
下列反应中,不是氧化还原反应的是 ( )①H2+Cl22HCl②Na2CO3+2HCl==2NaCl+H2O+CO2↑③2H2O2H2↑+O2↑④CuO+2HNO3==Cu(NO3)2+H2O⑤2HgO2Hg+O2↑A.②④B.①③C.①②③D.④⑤












