物质在水溶液中有不同的行为。按要求回答下列问题:(1)Na2SO3溶液显碱性 其原因是_______
| 物质在水溶液中有不同的行为。按要求回答下列问题: (1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。 (2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。 a.溶液中离子浓度 b.氨水的电离程度 c.水的离子积常数 d.c(H+)/ c(NH3·H2O) (3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。 |
参考解答
(1)SO32-+H2O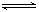 HSO3-+OH-(2分);(写一步即可得分) HSO3-+OH-(2分);(写一步即可得分)c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);(2分) (2) b,d(2分);a;(1分)c(1分) (3)相同(1分) Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同(2分) |
试题分析:(1)Na2SO3为弱酸强碱盐,SO32 ̄水解显碱性,离子方程式为:SO32-+H2O 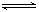 HSO3-+OH-;因为SO32 ̄水解,使溶液显碱性,所以离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。 HSO3-+OH-;因为SO32 ̄水解,使溶液显碱性,所以离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。(2)室温下向10mL氨水溶液中加水稀释后,氨水浓度减小,a、溶液中离子浓度减小;但水解平衡向右移动,所以b、氨水的电离程度增大;c、水的离子积常数受温度影响,不变;d、因为c(H+)/增大,c(NH3·H2O)减小,所以c(H+)/ c(NH3·H2O)增大。 (3)NaClO2做氧化剂转化为Cl ̄,3molNaClO2得12mol e ̄,3mol NaClO2变质可分解为2mol NaClO3和1mol NaCl,2mol NaClO3做氧化剂转化为Cl ̄,得12mol e ̄,所以取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相等。 |
相似问题
在50 mL a mol·L-1的硝酸溶液中 加入6.4g Cu 全部溶解 假设硝酸的还原产物只有N
在50 mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 m
金属钛(Ti)性能优越 被称为继铁 铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:aT
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:aTiO2+bCl2+cCaTiCl4+cCO……反应①TiCl4+2MgTi+2Mg
电镀厂镀铜废水中含有CN-和Cr2O72- 需要处理达标后才能排放。该厂拟定下列流程进行废水处理:回
电镀厂镀铜废水中含有CN-和Cr2O72-,需要处理达标后才能排放。该厂拟定下列流程进行废水处理:回答下列问题:(1)上述处理废水流程中主要使用的方法是_
某磁黄铁矿的主要成分是FexS(S为-2价) 既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与1
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应)
高铁酸钾(K2FeO4)具有很强的氧化性 在生产 生活中有广泛应用。(1)K2FeO4常用做高效水处
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。[已知:FeO42-+3e-+4H












