a mol FeS与b mol FeO投入V L c mol·L-1的稀硝酸溶液中充分反应 产生NO
| a mol FeS与b mol FeO投入V L、c mol·L-1的稀硝酸溶液中充分反应,产生NO气体, 所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( ) ①(a+b)×63 g ②(a+b)×189 g ③(a+b) mol ④(cV- 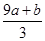 ) mol ) mol
|
参考解答
| D |
涉及氧化还原反应的知识往往是多种守恒原理的综合运用。本题综合运用原子守恒与电子得失守恒来求解。从题中叙述可知,该反应的产物主要有三种:Fe(NO3)3、H2SO4和NO,其中Fe(NO3)3中硝酸根离子的物质的量等于未被还原的硝酸的物质的量,由原子守恒得出生成的Fe(NO3)3的物质的量为(a+b) mol,则未被还原的硝酸的物质的量为3(a+b) mol,再乘以硝酸的摩尔质量可得出②是正确的。该反应中生成的NO是还原产物,a mol FeS被氧化失去9a mol电子,b mol FeO被氧化失去b mol电子,由得失电子守恒可知生成NO的物质的量为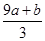 mol,再结合原子守恒可得出④是正确的。 mol,再结合原子守恒可得出④是正确的。 |
相似问题
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KC
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KClO3(混有KClO)。实验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一
磷是地壳中含量较为丰富的非金属元素 主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。(1)白磷(P4)可由C
下列说法正确的是( )A.常温常压下 22.4 L氯气与足量镁粉充分反应 转移的电子数为2NAB.
下列说法正确的是( )A.常温常压下,22 4 L氯气与足量镁粉充分反应,转移的电子数为2NAB.化合反应均为氧化还原反应C.电解NaCl溶液得到22 4 L H2(
(10分)将1.52g铜镁合金完全溶解于50.0mL密度为1.40g/mL 质量分数为63.0%的浓
(10分)将1 52g铜镁合金完全溶解于50 0mL密度为1 40g mL、质量分数为63 0%的浓硝酸中,得到NO2和N2O4的混合气体1120mL (标准状况),向反应后的溶液中加入
锌与很稀的硝酸反应生成硝酸锌 硝酸铵和水。当生成1 mol硝酸锌时 被还原的硝酸的物质的量为 (
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为 ( )。A.2 mol B.1 mol C.0 5 mol D.0 25 mol












