Ⅰ.某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图 已知NaClO2是一种强氧化性漂白剂
Ⅰ.某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图,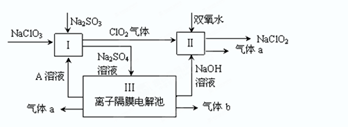 已知NaClO2是一种强氧化性漂白剂,广泛用于纺织、印染工业。它在碱性环境中稳定存在。 (1)双氧水的电子式为 ,装置Ⅰ中发生反应的还原剂是 (填化学式)。 (2)A的化学式是 ,装置Ⅲ电解池中A在 极区产生,若装置Ⅲ中生成气体a为 11.2 L(标准状况),则理论上通过电解池的电量为 (已知法拉第常数F="9.65×l" 04C· mol-1)。 (3)装置Ⅱ中反应的离子方程式是 。 Ⅱ.某实验B小组测定金属锡合金样品的纯度(仅含少量锌和铜,组成均匀),将样品溶于足量盐酸: Sn+ 2HCl=SnCl2+H2↑,过滤,洗涤。将滤液和洗涤液合并再加过量的FeCl3溶液。最后可用一定浓度的K2Cr2O7酸性溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有锡合金试样1.23g,经上述反应、操作后,共用去0.200mol/L的K2Cr2O7的酸性溶液15.00mL。 (4) 列式计算样品中锡的质量分数。 (5)用上述样品模拟工业上电解精炼锡,如图: 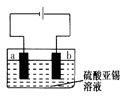 b极发生电极反应式 ,当得到11.90g纯锡时,电解质溶液质量减轻0.54g,则锡合金质量减少_______ g(结果保留一位小数)。 |
参考解答
(1)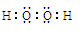 Na2SO3 Na2SO3 (2)H2SO4 阳 1.93×l 05C (3)2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O (4)87.1% 由关系式6Fe2+ ~ 3Sn2+ ~ Cr2O72– 得出n(Sn)='0.009' mol ∴ W%= 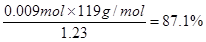 (5)Sn -2e-=Sn2+ Zn-2e-=Zn2+ 12.3g |
试题分析:(1)在双氧水分子中每个O原子与一个H原子形成共用电子对,再与另一个O原子形成共用电子对。所以它的电子式为 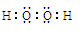 。在装置Ⅰ中发生反应NaClO3把Na2SO3氧化为Na2SO4,它本身被还原为ClO2.所以还原剂是Na2SO3。(2)在装置Ⅱ中中发生反应:ClO2+H2O2+NaOH=NaClO2+H2O+O2↑.Na2SO4溶液在装置Ⅲ电解池发生氧化还原反应:溶液中的阳离子的氧化性:H+>Na+,所以在阴极发生反应:2H++2e-=H2↑.由于破坏了附近的水的电离平衡,最终导致该区域的溶液显碱性,分离出NaOH溶液。溶液中的阴离子的还原性:OH->SO42-,所以在阳极发生反应为:4OH—+4e-=O2↑+2H2O。消耗了水电离产生的OH-,破坏了水的电离平衡,水继续电离。最终导致该区域的溶液显酸性。因此该阳极区产生的是氧气产物A为硫酸。化学式是H2SO4。n(O2)=' 11.2L÷' 22.4L/mol =0.5mol.则n(e-)=4×0.5mol=2mol.则理论上通过电解池的电量为2mol×9.65×l 04C/ mol=' 1.93×l' 05C.(3)装置Ⅱ中反应的化学方程式为ClO2+ H2O2+NaOH=NaClO2+H2O+O2↑的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O。(4)在反应过程中发生的反应为Sn2++ 2Fe3+= Sn4++ 2Fe2+, 6Fe2++Cr2O72- +14H+= 6Fe3++2Cr3++ 7H2O 。由方程式得关系式为:6Fe2+ ~ 3Sn2+ ~ Cr2O72–。n(Cr2O72-)= 0.200mol/L× 0.01500L=0.003mol.,所以n(Sn)='0.009' mol.m(Sn)=' 0.009' mol×119g/mol=1.071g.所以样品中锡的质量分数W%= 。在装置Ⅰ中发生反应NaClO3把Na2SO3氧化为Na2SO4,它本身被还原为ClO2.所以还原剂是Na2SO3。(2)在装置Ⅱ中中发生反应:ClO2+H2O2+NaOH=NaClO2+H2O+O2↑.Na2SO4溶液在装置Ⅲ电解池发生氧化还原反应:溶液中的阳离子的氧化性:H+>Na+,所以在阴极发生反应:2H++2e-=H2↑.由于破坏了附近的水的电离平衡,最终导致该区域的溶液显碱性,分离出NaOH溶液。溶液中的阴离子的还原性:OH->SO42-,所以在阳极发生反应为:4OH—+4e-=O2↑+2H2O。消耗了水电离产生的OH-,破坏了水的电离平衡,水继续电离。最终导致该区域的溶液显酸性。因此该阳极区产生的是氧气产物A为硫酸。化学式是H2SO4。n(O2)=' 11.2L÷' 22.4L/mol =0.5mol.则n(e-)=4×0.5mol=2mol.则理论上通过电解池的电量为2mol×9.65×l 04C/ mol=' 1.93×l' 05C.(3)装置Ⅱ中反应的化学方程式为ClO2+ H2O2+NaOH=NaClO2+H2O+O2↑的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O。(4)在反应过程中发生的反应为Sn2++ 2Fe3+= Sn4++ 2Fe2+, 6Fe2++Cr2O72- +14H+= 6Fe3++2Cr3++ 7H2O 。由方程式得关系式为:6Fe2+ ~ 3Sn2+ ~ Cr2O72–。n(Cr2O72-)= 0.200mol/L× 0.01500L=0.003mol.,所以n(Sn)='0.009' mol.m(Sn)=' 0.009' mol×119g/mol=1.071g.所以样品中锡的质量分数W%=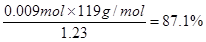 。(5)电解精炼Sn时,用粗Sn作阳极,精Sn作阴极。含Sn2+离子的溶液作电解质溶液。所以b极为阳极。阳极电极反应式Sn -2e-=Sn2+;Zn-2e-=Zn2+。阴极电极反应式为:Sn2++2e-=Sn。即相当于一部分的Sn是Zn发生置换反应Zn+Sn2+=Zn2++Sn。阳极每有65gZn反应,阴极生成Sn119g,溶液减轻54g.现在溶液减轻0.54g,则发生反应的Zn为0.01mol,其质量为0.65g,由该Zn置换出来的Sn为0.01mol。其质量为1.19g.所以参加反应的锡质量为11.90-1.19= 10.71g,因为Sn的含量为87.1%,所以Sn合金的质量为10.71g÷87.1%=12.3g. 。(5)电解精炼Sn时,用粗Sn作阳极,精Sn作阴极。含Sn2+离子的溶液作电解质溶液。所以b极为阳极。阳极电极反应式Sn -2e-=Sn2+;Zn-2e-=Zn2+。阴极电极反应式为:Sn2++2e-=Sn。即相当于一部分的Sn是Zn发生置换反应Zn+Sn2+=Zn2++Sn。阳极每有65gZn反应,阴极生成Sn119g,溶液减轻54g.现在溶液减轻0.54g,则发生反应的Zn为0.01mol,其质量为0.65g,由该Zn置换出来的Sn为0.01mol。其质量为1.19g.所以参加反应的锡质量为11.90-1.19= 10.71g,因为Sn的含量为87.1%,所以Sn合金的质量为10.71g÷87.1%=12.3g. |
相似问题
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S2Al2O3+9SO2↑ 下列有关说
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S2Al2O3+9SO2↑,下列有关说法中正确的是()A.反应中Al2(SO4)3被氧化B.Al2 (SO4)3、Al2O3均含有离
分类法对研究化学物质和化学反应有重要的意义 请完成下列问题.(1)今有八种物质:①铝 ②熔化的K
分类法对研究化学物质和化学反应有重要的意义,请完成下列问题.(1)今有八种物质:①铝②熔化的KNO3③石墨④NaCl晶体⑤纯硫酸 ⑥石灰水⑦乙醇⑧BaSO4
200°C时 11.6克CO2和水蒸气的混合气体与足量的Na2O2充分反应后 固体的质量增加了3.
200°C时,11 6克CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体的质量增加了3 6克。从以上信息中,我们得出的下列结论中不正确的是( )A.可以
向含有Fe2+ I- Br-的溶液中通入适量氯气 溶液中各种离子的物质的量变化如图所示。有关说法不正
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是A.线段BC代表Fe3+物质的量的变化情况B.原混
实验室采用MgCl2 AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:⑴制备Mg
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式。⑵如图所示,过滤操












