肼(N2H4)是氮和氢形成的一种化合物 易溶于水.工业上利用尿素法生产肼 同时得到副产品十水合碳酸钠
肼(N2H4)是氮和氢形成的一种化合物,易溶于水.工业上利用尿素法生产肼,同时得到副产品十水合碳酸钠,其工艺流程如下: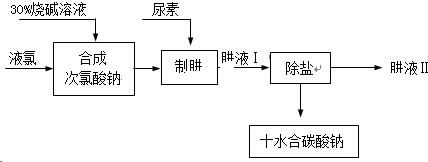 十水合碳酸钠制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O. (1)实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有______(选填编号). A.漏斗 B.烧杯 C.烧瓶 D.量筒 (2)已知:Cl2+H2O=HCl+HClO,请推测Cl2与NaOH溶液发生反应的化学方程式:______. 从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71:______. (3)在实验室中,欲从母液中分离出十水合碳酸钠晶体.可采用的操作依次为______(选填编号). A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶 (4)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等.请写出肼除氧时发生反应的化学方程式:______. |
参考解答
| (1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择BD; (2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80; (3)碳酸钠的溶解度随温度变化比较大从溶液中结晶析出的方法:冷却热饱和溶液的方法,所以先将溶液加热蒸发,再降温,使晶体析出,再进行过滤,所以步骤为:BED. (4)肼除氧的反应物是肼和氧气,因为氧化产物无污染所以是氢和氧结合成的水,根据质量守恒定律可知生成物还有氮气,再根据观察法配平,所以方程式是:N2H4+O2=N2+2H2O. 故答案为:(1)BD;(2)Cl2+2NaOH=NaCl+NaClO+H2O;80;(3)BED;(4)N2H4+O2=N2+2H2O. |
相似问题
石英是一种物理性质和化学性质均十分稳定的矿产资源 石英的主要成分为二氧化硅 它是玻璃工业和陶瓷工业的
石英是一种物理性质和化学性质均十分稳定的矿产资源,石英的主要成分为二氧化硅,它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂.(1)二氧化硅的结构
你玩过“盖房子”的游戏吗?如右图所示 游戏规则是根据“上下相邻的物质间均可发生化学反应 且左边上下相
你玩过“盖房子”的游戏吗?如右图所示,游戏规则是根据“上下相邻的物质间均可发生化学反应,且左边上下相邻物质间反应均有气体产生”来堆物质。根据上
提供以下资料:(1)(2)CuO+H2SO4==CuSO4+H2O(3)Cu(OH)2+H2SO4=
提供以下资料:(1)(2)CuO+H2SO4==CuSO4+H2O(3)Cu(OH)2+H2SO4==CuSO4+2H2O初三(3)班的化学兴趣小组设计用废铜屑制取硫酸铜,四位同学的设计方案
已知海水中含有氯化镁 但因其含量低而不能用于生产镁.某工厂利用海水和海边丰富的贝壳(主要成分是CaC
已知海水中含有氯化镁,但因其含量低而不能用于生产镁.某工厂利用海水和海边丰富的贝壳(主要成分是CaCO3)资源来制取氢氧化镁,然后制取较纯净的氯化镁
按图序号写出符合下列要求方程式:H2O(1)A(2)H2O(3)B(4)H2O化合反应______
按图序号写出符合下列要求方程式:H2O(1)A(2)H2O(3)B(4)H2O化合反应______分解反应______置换反应______其他反应______.












