在下面反应中 2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O(1)氧化剂是_
| 在下面反应中,2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O (1)氧化剂是______,氧化产物是______. (2)用“双线桥”标出电子转移的方向和数目. (3)该反应中被氧化和未被氧化的盐酸的物质的量之比是______,若有7.3g HCl被氧化,产生Cl2的质量为______g,转移电子______mol. (4)如果将20ml12mol?L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将______. A.≥1.68LB.>1.68LC.≤1.68LD.<1.68L. |
参考解答
| 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高, (1)Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高,所以氧化产物为,故答案为:KMnO4;Cl2; (2)该反应中Mn得到2×5e-,Cl失去10×e-,则双线桥法表示反应转移的电子的方向和数目为 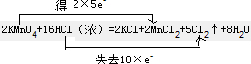 , ,故答案为:  ; ;(3)由反应可知,16molHCl反应时只有10molHCl作还原剂别氧化,所以该反应中被氧化和未被氧化的盐酸的物质的量之比是10:6=5:3; 若有7.3g HCl被氧化,n(HCl)=
故答案为:5:3;7.1;0.2; (4)20ml12mol?L-1的浓盐酸与足量KMnO4充分反应,n(HCl)=0.02L×12mol/L=0.24mol,若完全反应生成氯气为0.24mol×
故答案为:D. |
相似问题
下列反应中 属于氧化还原反应的是( )A.2H2O2催化剂.2H2O+O2↑B.2Al(OH)3△
下列反应中,属于氧化还原反应的是( )A.2H2O2催化剂 2H2O+O2↑B.2Al(OH)3△ Al2O3+3H2OC.FeO+2HCl=FeCl2+H2OD.CuCl2+2NaOH=Cu(OH)2↓+2NaCl
从海水中提取澳时涉及到如下反应:Cl2+2NaBr=Br2+2NaCl 下列有关该反应的说法不正确的
从海水中提取澳时涉及到如下反应:Cl2+2NaBr=Br2+2NaCl,下列有关该反应的说法不正确的是( )A.Cl2是氧化剂B.NaBr是还原剂C.该反应属于置换反应D
已知下列反应:14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2↑+7H2O 该反应的氧化
已知下列反应:14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2↑+7H2O,该反应的氧化剂是______,还原产物是______,既不是氧化产物又不是还原产物的是______,电子转移总数是______.
氨气与氧化铜反应的化学方程式为:3CuO+2NH3催化剂加热3Cu+N2+3H2O 完成下列填空:(
氨气与氧化铜反应的化学方程式为:3CuO+2NH3催化剂加热3Cu+N2+3H2O,完成下列填空:(1)该反应的还原剂是______,发生还原反应的物质是______.(2)在
下列反应中 水既不是氧化剂 又不是还原剂的氧化还原反应是( )A.2Na+2H2O═2NaOH+H
下列反应中,水既不是氧化剂,又不是还原剂的氧化还原反应是( )A.2Na+2H2O═2NaOH+H2↑B.2F2+2H2O═4HF+O2C.2Na2O2+2H2O═4NaOH+O2↑D.MgO+H2O═Mg(OH)2












