某校化学兴趣小组的同学欲测定某种品牌纯碱中食盐的含量。①称取某纯碱样品10.0 g放入烧杯中 并加适
| 某校化学兴趣小组的同学欲测定某种品牌纯碱中食盐的含量。 ①称取某纯碱样品10.0 g放入烧杯中,并加适量蒸馏水使之完全溶解。 ②____________________________________。 ③____________________________________。 ④用蒸馏水洗涤沉淀2—3次。 ⑤将沉淀烘干、称量,测得固体质量2.87 g。 (1)补齐所缺少的实验步骤,将答案填写在上面②和③的空格处。 (2)实验步骤③所用的玻璃仪器有:____________________________________。 (3)在过滤器上洗涤沉淀的具体操作是:____________________________________。 (4)检验沉淀是否洗涤干净的方法是:____________________________________。 (5)若纯碱标签上标注:“Na2CO3含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?________(填“合格”或“不合格”)。 |
参考解答
| (1)②加入硝酸酸化的硝酸银溶液于样品溶液中,直到不再产生沉淀为止③将②所得溶液过滤 (2)漏斗、玻璃棒、烧杯 (3)向漏斗里注入蒸馏水,使水面浸过沉淀物,等水流完后,重复操作2—3次 (4)取最后几滴洗出液加稀盐酸,若无浑浊现象,说明沉淀已洗净 (5)合格 |
| 实验目的的是“测定纯碱(Na2CO3)中食盐(NaCl)的含量”。 首先,分析该实验是测碳酸盐沉淀还是氯化物沉淀。因为样品质量是10.0 g,而沉淀质量是287 g,一般形成的沉淀多为重金属盐,可初步判定该沉淀应是NaCl形成的不溶性氯化物(一般AgCl)。 其次,要注意形成AgCl沉淀并测量时,要先排除Ag2CO3的干扰。 (1)因此可知,第②步实验步骤是“加入用HNO3酸化的AgNO3溶液于样品溶液中,直到不再产生沉淀为止”,而第③步实验步骤是“将所得溶液过滤”。 (2)“过滤”所用的玻璃仪器有漏斗、烧杯和玻璃棒。 (3)洗涤沉淀的具体操作是向过滤器(或漏斗)中注入蒸馏水,使其浸没沉淀,待过滤完毕后,重复此操作2—3次。 (4)检验沉淀是否洗涤干净的方法是取洗涤后的滤液,加入稀盐酸,若无沉淀产生,说明沉淀已洗干净。因为AgCl沉淀表面主要附着AgNO3,所以此处是检验Ag+。 (5)计算样品中的NaCl的含量:NaCl—AgCl w(NaCl)= 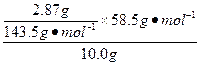 ×100%=11.7% ×100%=11.7%可知此样品合格。 |
相似问题
下列有关钠的叙述中错误的是( )A.电解法冶炼金属钠时 钠在阳极析出B.钠的化学性质非常活泼 钠
下列有关钠的叙述中错误的是()A.电解法冶炼金属钠时,钠在阳极析出B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界C.钠的还原性很强,可以
请用下列物质的序号填空: A.Na2O2B.Na2CO3C.NaHCO3D.K- Na合金 E.Na
请用下列物质的序号填空:A.Na2O2B.Na2CO3C.NaHCO3D.K- Na合金 E.Na F.Ca(ClO)2 G.CaCO3 H.NaCl(1)可用于潜艇中供氧剂的是;(2)可用于
金属钠分别与下列溶液反应时 既有气体又有白色沉淀产生的是:A FeCl3溶液 B BaCl2
金属钠分别与下列溶液反应时,既有气体又有白色沉淀产生的是:A FeCl3溶液 B BaCl2溶液 C MgCl2溶液 D NH4Cl溶液
下列有关Na2CO3和NaHCO3性质的说法中 正确的是A.热稳定性:Na2CO3
下列有关Na2CO3和NaHCO3性质的说法中,正确的是A.热稳定性:Na2CO3<NaHCO3B.相同温度下,在水中Na2CO3的溶解度小于NaHCO3C.106gNa2CO3和84gNaHCO3分别
下列说法正确的是( )A.从氧化还原角度考虑 钠原子只有还原性 钠离子只有氧化性B.Na在空气中
下列说法正确的是()A.从氧化还原角度考虑,钠原子只有还原性,钠离子只有氧化性B.Na在空气中燃烧生成淡黄色的Na2O2,所以,Na2O比Na2O2稳定C.在化学












