有Na2CO3 NaHCO3 CaO和NaOH组成的混合物27.2g 把它们溶于足量的水中 充分反应
| 有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+,CO32-、HCO32-均转化为沉淀,将反应器内水分蒸干,最后得到白色固体物质共29g,则原混合物中Na2CO3的质量是多少? |
参考解答
| 10.6g |
| 按一般的常规解法——运用化学方程式列出方程组进行求解的话,很难获得正确答案。如果根据题意,远用微粒(Na+,CO32-)守恒的原理剖析题意,会很快找到解题的捷径。 从“溶液中的Ca2+、CO32-、HCO3-均转化为沉淀”可知:原混合物中Na2CO3和NaHCO3的物质的量之和必定等于CaO的物质的量。而最后得到的白色固体中NaOH的物质的量必定等于原混合物中Na2CO3、NaHCO3和NaOH中所含Na+的物质的量之和,可图示如下:  由上图解不难看出,质量差29-27.2=1.8(g)的实质,相当于x mol Na2O转化为2x mol NaOH的质量差。 即:Na2O→2NaOH Δm 1mol 80g 80g-62g=18g xmol 29g-27.2g=1.8g 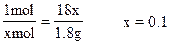 所以:含Na2CO3为10.6g。 |
相似问题
实验室用如图所示装置分离CO2和CO气体并干燥。请完成(1)—(2)两个小题。图3-9(1)图中a为
实验室用如图所示装置分离CO2和CO气体并干燥。请完成(1)—(2)两个小题。图3-9(1)图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹c、d分别接
在1L1mol·L-1 NaOH溶液中通入16.8L标准状况下的CO2 充分反应后判断所得溶液的溶质
在1L1mol·L-1 NaOH溶液中通入16 8L标准状况下的CO2,充分反应后判断所得溶液的溶质为何物及计算所得溶液中含有溶质物质的量浓度(设反应后,溶液的体积仍为1L)。
下列有关实验的操作过程 正确的是( )A.钠与水的反应:用镊子从试剂瓶中取出金属钠 用小刀切下绿豆
下列有关实验的操作过程,正确的是( )A.钠与水的反应:用镊子从试剂瓶中取出金属钠,用小刀切下绿豆粒大小的一粒钠小心放入装满水的烧杯中B.配制1
(1)用金属钠制取过氧化钠的化学方程式为________________________。 (2)用
(1)用金属钠制取过氧化钠的化学方程式为________________________。 (2)用金属钠制取氧化钠通常利用反应2NaNO2+6Na=4Na2O+N2↑,而不采用钠在氧气中燃烧
某课外小组在做过氧化钠与水反应的实验时 发现向反应后的溶液中滴加酚酞试液时 溶液呈现红色 但红色很快
某课外小组在做过氧化钠与水反应的实验时,发现向反应后的溶液中滴加酚酞试液时,溶液呈现红色,但红色很快褪去。根据对实验现象的观察和思考,甲、乙、












