某校化学研究性学习小组设计如下实验方案 测定放置已久的小苏打样品中纯碱的质量分数。(1)方案一:称取
| 某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。 (1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是_________________。 (2)方案二:按下图装置进行实验。并回答以下问题: 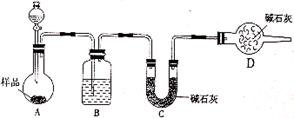 ①分液漏斗中应该装___________(填“盐酸”或“稀硫酸”),D装置的作用是_________________________________; ②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化。 (3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算: ①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_____________; ②若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥后的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(保留一位小数)。 |
参考解答
| (共12分) (1)使NaHCO3分解完全 (2)①稀硫酸,防止外界CO2、H2O被装置C中的碱石灰吸收。 ②C(用字母表示); (3)①玻璃棒;②55.8%(保留一位小数)。(每空2分) |
试题分析:(1)小苏打即NaHCO3,加热易分解,故加热至恒重的目的是使NaHCO3分解完全。 (2)①盐酸易挥发,故分液漏斗中应该装稀硫酸,碱石灰能吸收空气中的水蒸气和CO2,故D装置的作用是防止外界CO2、H2O被装置C中的碱石灰吸收。 ②A生成CO2气体经B干燥后到C中进行吸收,故还需称C装置前后质量的变化。 (3)①过滤常用的玻璃仪器有烧杯、漏斗和玻璃棒。 ②发生反应Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O. 样品9.5g,干燥的沉淀碳酸钡质量为19.7g,物质的量为19.7g/(197g/mol) =0.1mol,令样品中碳酸钠的物质的量为xmol、碳酸氢钠的物质的量为ymol,则106x+84y=9.5,x+y=0.1,解得x=0.05,y=0.05.所以碳酸钠的质量为106g/mol×0.05mol=5.3g,所以碳酸钠质量分数为5.3g/9.5g×100%=55.8%。 点评:以实验探究“测定放置已久的小苏打样品中纯碱的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题。 |
相似问题
在“绿色化学实验进课堂”活动中 某同学为“氯气与金属钠反应”设计了下图装置与操作以替代相关的课本实验
在“绿色化学实验进课堂”活动中,某同学为“氯气与金属钠反应”设计了下图装置与操作以替代相关的课本实验。将一根玻璃管与氯气发生器相连,玻璃管内放
将一小块钠放入下列溶液时 既能产生气体 又会出现白色沉淀的是A.稀盐酸B.氢氧化钠稀溶液C.硫酸铜溶
将一小块钠放入下列溶液时,既能产生气体,又会出现白色沉淀的是A.稀盐酸B.氢氧化钠稀溶液C.硫酸铜溶液D.氯化镁溶液
为鉴别K2CO3和NaHCO3两种白色固体 有4位同学分别设计了以下四种不同的方案 其中方法和现象判
为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了以下四种不同的方案,其中方法和现象判断不正确的是A.用铂丝粘取固体在酒精灯火焰上灼烧,观察火
把适量Na2O2加入下列饱和溶液中 原溶液溶质的浓度基本不变的是A.NaClB.Na2SO3C.Mg
把适量Na2O2加入下列饱和溶液中,原溶液溶质的浓度基本不变的是A.NaClB.Na2SO3C.MgCl2D.NaHCO3
下列说法正确的是( )。A.Na与足量O2反应 随温度升高生成Na2O的速率逐渐加快B.Na2O和
下列说法正确的是( )。A.Na与足量O2反应,随温度升高生成Na2O的速率逐渐加快B.Na2O和Na2O2中的阴阳离子个数比不相等C.用洁净铂丝蘸取溶液进行焰色












