X Y Z M G五种元素分属三个短周期 且原子序数依次增大。X是元素周期表中原子半径最小的元素 X
| X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X是元素周期表中原子半径最小的元素,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。 请回答下列问题: (1)Y在元素周期表中的位置为 ,ZX的电子式为 。 (2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。 (3)Y、G的单质或两元素之间形成的化合物可作消毒剂的有 、 (写出其中两种物质的化学式)。 (4)X2M的标准燃烧热ΔH=-a kJ·mol-1,写出表示X2M标准燃烧热的热化学方程式: 。 |
参考解答
(1)第二周期ⅥA族,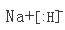 (2) HClO4,H2S (3)O3、Cl2、ClO2(写出2种即可) |
试题分析:X是元素周期表中原子半径最小的元素,X是H元素;X、Z同主族,可形成离子化合物ZX,Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子。则Y、M是O、S元素;G只能是Cl元素。 (1)O在元素周期表中的位置为第二周期ⅥA族,NaH是离子化合物,所以电子式为 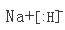 (2)上述元素的最高价氧化物对应的水化物酸性最强的也是非金属性最强的,是氯元素对应的高氯酸分子式为HClO4,非金属气态氢化物还原性最强的也是非金属性最弱的,是S对应的硫化氢,化学式为H2S; (3)O、Cl的单质或两元素之间形成的化合物可作消毒剂的有O3、Cl2、ClO2 (4)H2S对应的稳定氧化物是液态水和气态二氧化硫,所以X2M标准燃烧热的热化学方程式为: H2S(g)+3/2O2(g)= H2O(l)+SO2(g) ΔH=-a kJ·mol-1 |
相似问题
下列关于元素周期律的叙述正确的是( )。A.随着元素原子序数的递增 原子最外层电子数总是从1到8重
下列关于元素周期律的叙述正确的是( )。A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现B.随着元素原子序数的递增,原子半径从大到小(
短周期元素R T Q W G在元素周期表中的相对位置如下图所示 其中Q是无机非金属材料的主角。下列判
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是RTQWGA.离子半径:T< W< GB.最简单气
19世纪中叶 门捷列夫的突出贡献是( )A.提出原子学说B.发现元素周期律C.提出分子学说D.提
19世纪中叶,门捷列夫的突出贡献是()A.提出原子学说B.发现元素周期律C.提出分子学说D.提出电离学说
I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20 该笼状结构是由许多正五边形构成
、I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。①C20分子中每个碳原子只跟相邻的3个碳原子形
X Y Z均为短周期元素。已知X元素的某种原子核内无中子 Y元素的原子核外最外层电子数是其次外层电子
X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含












