(15分)A B D E F为短周期元素 非金属元素A最外层电子数与其周期数相同 B的最外层电子数是
| (15分) A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题: (1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。 (2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。 (3)由这些元素组成的物质,其组成和结构信息如下表:
d的晶体类型是 。 (4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。 |
参考解答
⑴第一周期IA族 2Cl- +2H2O 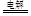 2OH- +H2↑+C12↑(或2NaCl(熔融) 2OH- +H2↑+C12↑(或2NaCl(熔融)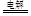 2Na+Cl2。↑(每空2分) 2Na+Cl2。↑(每空2分)⑵纯碱(或苏打)(1分) 2Na2CO3+Cl2+H2O = NaClO+NaCl+2NaHCO3 ( 2分)紫(1分) ⑶NaH (1分) Na2〇2和Na2C2 ( 2分) 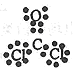 (1分) 金属晶体(1分) (1分) 金属晶体(1分)⑷氢(1分)正四面体(1分) |
| 试题分析:根据“非金属元素A最外层电子数与其周期数相同”确定A为氢元素,然后根据其它信息推出B为碳元素,D为氧元素,E为钠元素,F为氯元素。 ⑴H在周期表中的位置为第一周期IA族;工业制备上Cl2的原理有电解饱和食盐水或电解熔融的NaCl,据此便可写出其相应的离子方程式。 ⑵C、O、Na组成的一种盐中,满足E的质量分数为43%的盐为Na2CO3,俗称纯碱或苏打;其水溶液与Cl2反应,可理解为Cl2先与水反应有HCl和HClO,Na2CO3水解有NaHCO3和NaOH,二者再反应,可确定其生成物有NaClO、NaCl 、NaHCO3,然后通过氧化还原反应的配平方法将其配平;在产物中加入少量KI,NaClO将KI氧化生成I2,反应后加人CC14并振荡溶液显紫色。 ⑶在这些元素中只有Na才与H形成二元离子化合物NaH(a的化学式);形成含有非极性共价键的二元离子化合物,且原子数之比为1:1的物质有Na2〇2和Na2C2(b的化学式);BDF2的化学式为COCl2,其结构式为 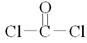 ,据此便可写出其电子式 ,据此便可写出其电子式 ;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。 ;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。⑷由H和C、O元素组成的两种二元化合物CH4、H2O能形成一类新能源物质,一种化合物分子(H2O)通过氢键构成具有空腔的固体;另一种化合物(沼气的主要成分CH4)分子进入该空腔,CH4分子的空间结构为正四面体结构。 |
相似问题
下列化学用语中 不正确的是A.氯原子结构示意图: B.HCl的电子式:C.H2O分子的结构式:H-O
下列化学用语中,不正确的是A.氯原子结构示意图: B.HCl的电子式:C.H2O分子的结构式:H-O-HD.乙炔的比例模型:
A B C D E F为短周期六种元素 原子序数依次增大 其中A与E同主族且能形成离子化合物EA B
A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍
几种短周期元素的原子半径及主要化合价如下表:元素代号XYZMRQ原子半径(×10-10 m)1.86
几种短周期元素的原子半径及主要化合价如下表:元素代号XYZMRQ原子半径(×10-10 m)1 860 991 431 600 750 74主要化合价最高正价+1+7+3+2+5——最低负价
某周期第二主族元素的原子序数为x 则同周期第三主族元素的原子序数是 ( )A.只有x+1B.可能是x
某周期第二主族元素的原子序数为x,则同周期第三主族元素的原子序数是 ()A.只有x+1B.可能是x+1或x+11或x+25C.可能是x+8D.可能是x+2
如图所示是部分短周期元素化合价与原子序数的关系图 下列说法正确的是A.原子半径:Z>Y>XB.气态氢
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是A.原子半径:Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成离子化合物D.Y












