某温度下 测得氢氧化钠的PH=11水的离子积常数KW是多少?(1)该温度下 水的离子积常数KW是多少
某温度下,测得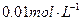 氢氧化钠的PH=11水的离子积常数KW是多少? 氢氧化钠的PH=11水的离子积常数KW是多少?(1)该温度下,水的离子积常数KW是多少? (2)在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。 ①若所得混合溶液为中性,且a=12,b=2,则Va : Vb为多少? ②若所得混合溶液为中性,且a+b=12,则Va : Vb为多少? |
参考解答
| (1)10—13 (2)①1 : 10 ②10 : 1 |
(1)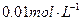 氢氧化钠的 氢氧化钠的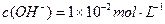 , ,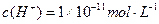 ,所以该温度下,水的离子积常数KW= ,所以该温度下,水的离子积常数KW=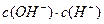 = =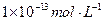 。(2)①若所得混合溶液为中性,pH=12的NaOH溶液,则意味 。(2)①若所得混合溶液为中性,pH=12的NaOH溶液,则意味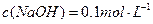 , ,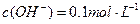 ,pH=2的硫酸, ,pH=2的硫酸,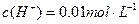 ,所以有 ,所以有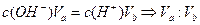 = =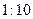 。② 。②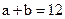 ,则 ,则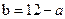 ,所以 ,所以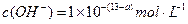 , ,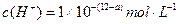 ,所以 ,所以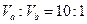 。 。 |
相似问题
如果NO3- Fe2+ SO42- M四种离子以物质的量之比4:2:1:2共存于同一溶液中 那么 M
如果NO3-、Fe2+、SO42-、M四种离子以物质的量之比4:2:1:2共存于同一溶液中,那么,M可能是( )A.Cl-B.H+C.Na+D.Mg2+
下列各组离子 能在水溶液中大量共存的是( )A.Ba2+ H+ NO3- OH-B.Mg2+ H+
下列各组离子,能在水溶液中大量共存的是( )A.Ba2+、H+、NO3-、OH-B.Mg2+、H+、Cl-、SO42-C.Na+、Ca2+、CO32-、SO42-D.Ca2+、Ag+、OH-、HCO3-
下列化学过程及其表述正确的是
下列化学过程及其表述正确的是()A.向NaSO,溶液中滴人Ba(OH)2溶液呈中性 H++SO2-4+Ba2++OH-===BaSO4↓+H2OB.由水电离的c(H+)=10-13mol·L-1的溶
常温下 由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中 一定不能大量共存的离子组
常温下,由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中,一定不能大量共存的离子组是A.Cl- AlO2- Na+ K+B.Fe3+ NO3- MnO4- K+C
不能证明HA是弱酸的是( ) A.常温下 NaA溶液的pH='9'B.0.01 mol·L-1
不能证明HA是弱酸的是()A.常温下,NaA溶液的pH= "9 "B.0 01 mol·L-1HA溶液的pH=4C.pH=2的HA溶液稀释100倍后pH= "3 5 "D.HA溶液跟锌反应,放出H2很慢












