磷酸(H3PO4)在溶液中能够以H3PO4 H2PO4- HPO42- 和PO43-四种粒子形式存在
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线: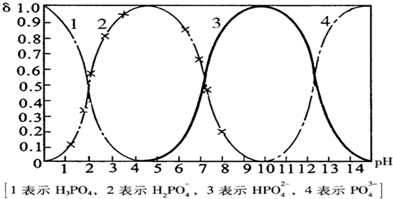 (1)设磷酸总浓度为c(总),写出c(总)与各粒子浓度间的关系式______. (2)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为______.当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是______. (3)从图中推断NaH2PO4溶液呈______性(填“酸”、“碱”、或“中”),其原因是______. (4)在Na3PO4溶液中,c(Na+)/c(PO43-)______3(填“>”、“═”、或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是______. |
参考解答
| (1)磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,无论以何种离子存在,但总的P原子总数与原磷酸中P原子相对, 所以c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-), 故答案为:c(总)=c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-); (2)根据图象知,当向溶液中滴加稀盐酸时,溶液中H2PO4-增加,HPO42-减少,所以是溶液中的HPO42-和氢离子发生生成H2PO4-,离子方程式为:HPO42-+H+═H2PO4-, 当pH=7时,根据图象知,溶液中存在的阴离子为H2PO4-、HPO42-, 故答案为:HPO42-+H+═H2PO4-;H2PO4-、HPO42-; (3)根据图象知,当溶液中存在H2PO4-时,溶液呈酸性,说明H2PO4-在溶液中的电离程度大于水解程度,导致溶液中氢离子浓度大于氢氧根离子的浓度, 故答案为:酸;H2PO4-在溶液中的电离程度大于水解程度; (4)磷酸钠是强碱弱酸盐,所以弱酸根离子能发生水解,导致溶液中c(Na+)/c(PO43-)>3; PO43-+H2O?HPO42-+OH-,当向溶液中滴入几滴浓KOH溶液后,根据勒夏特列原理知,水解平衡向逆反应方向移动,所以导致溶液中磷酸根离子的浓度增大,故c(Na+)/c(PO43-)的值减小. 故答案为:>;KOH抑制了PO43-的水解. |
相似问题
下列离子方程式正确的是( )A.碳酸氢镁溶液和过量的NaOH溶液反应:Mg2++2OH-=Mg(O
下列离子方程式正确的是( )A.碳酸氢镁溶液和过量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓B.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2+
A B X Y Z W Q R是原子序数依次增大的八种短周期主族元素 A和B Z和W左右相邻 A和Z
A、B、X、Y、Z、W、Q、R是原子序数依次增大的八种短周期主族元素,A和B、Z和W左右相邻,A和Z、B和W上下相邻;Y在同周期中原子半径最大,R在同周期中原子
碘是一种与人的生命活动密切相关的元素.已知碘单质能溶于NaOH或KI溶液 反应方程式分别为:I2+6
碘是一种与人的生命活动密切相关的元素.已知碘单质能溶于NaOH或KI溶液,反应方程式分别为:I2+6OH-=5I-+IO3-+3H2O(HIO不稳定,易发生歧化反应)和I2+I-
A为中学化学常见金属单质 将A投入足量B的浓溶液中 溶液总质量在反应前后保持不变(忽略沉淀或气体的溶
A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X
下列离子方程式的书写正确的是( )A.将O.O1mol氯气通入1OmL1mol/L的FeBr2溶液
下列离子方程式的书写正确的是( )A.将O.O1mol氯气通入1OmL1mol L的FeBr2溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2B.弱酸尼泊金酸()与足量碳酸












